多種實體腫瘤至今仍缺乏有效的治療方法,臨床治療通常需要多種藥物聯合使用。例如,膠質瘤是成人中最常見的原發性惡性腦腫瘤,單靠外科切除往往無法治愈。患者的預後較差,腫瘤復發率較高,五年生存率僅為5%,目前可用的治療方式極為有限。考慮到腫瘤基因組的復雜性以及涉及的多條訊號通路,單一的治療方式可能無法有效應對。因此,亟需研究針對不同致癌通路的組合治療方法。
雷帕黴素靶蛋白(mTOR)是一種在哺乳動物細胞中起著關鍵作用的蛋白激酶,參與細胞生長、增殖和存活等過程,同時也在腦膠質瘤的發生開發中發揮重要作用。然而mTOR激酶抑制劑的選擇性差導致了較高的毒性和較差的臨床安全性,同時耐藥性問題進一步削弱了其臨床療效。這些因素極大地限制了mTOR抑制劑的臨床套用,至今尚未有除雷帕黴素之外的mTOR抑制劑獲批上市。
分子膠技術是一種新型的藥物開發方法,近年來受到了廣泛關註。該方法透過誘導靶蛋白降解來調節蛋白功能,以催化迴圈和事件驅動的作用模式,有望克服小分子抑制劑的耐藥性。G1到S期過渡蛋白1(GSPT1)主要調控蛋白轉譯終止過程,並與多種腫瘤的發生發展密切相關。GSPT1在膠質母細胞瘤細胞中高表達,透過長鏈非編碼RNA MINCR調控miR-876-5p/GSPT1軸,促進膠質母細胞瘤的進展。目前已有多種GSPT1降解劑被報道,並且一些已進入臨床研究階段。
有研究表明,mTOR抑制劑耐藥原因之一可能是由於GSK3β表達量降低,而GSPT1的降解會促使GSK3β的表達上調,有望克服其耐藥。與此同時,mTOR的抑制能有效增強GSPT1降解劑活性。此外,mTOR抑制和GSPT1降解在細胞轉譯的始末具有協同作用。因此同時抑制mTOR並降解GSPT1為惡性腫瘤提供了一種新的聯合治療策略。
近日,清華大學藥學院饒燏團隊合作研究開發了一個雙靶雙機制小分子YB-3-17,它能夠高效、選擇性地抑制mTOR同時降解GSPT1,對腫瘤細胞增殖抑制活性優於單一治療及其聯合使用。此外,YB-3-17能夠在小鼠模型中安全有效地抑制腫瘤的生長。研究人員首次將mTOR抑制與GSPT1蛋白降解結合起來,展示了將小分子抑制劑和降解劑特性成功整合到單一分子中的概念性與可行性,「一石二鳥」的策略有望達到「事半功倍」的效果,為膠質瘤的精準治療提供了一個有前景的方向。
首先基於雙靶雙機制的設計理念,研究人員結合多種mTOR抑制劑與E3泛素連線酶配體,並考慮分子膠的特性,構建了獨特的分子膠化合物庫(圖1A)。研究人員經過多輪篩選後得到了一個苗頭化合物YB-2-43,並經過進一步最佳化後得到活性最優的雙功能分子YB-3-17(圖1A)。該分子能夠高效抑制mTOR並降解GSPT1(圖1B,C)。
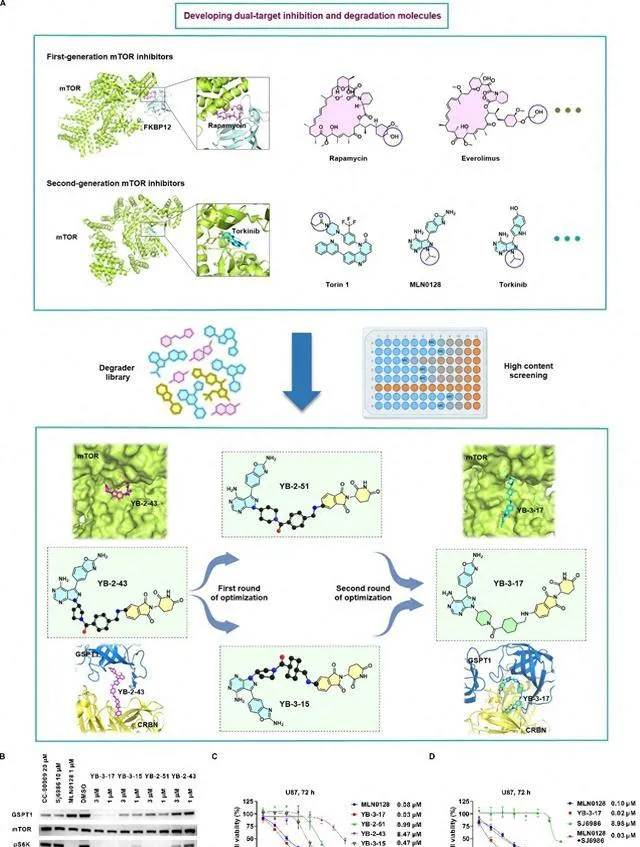
圖1.雙靶雙機制小分子YB-3-17的開發及評價
隨後,研究人員對YB-3-17進行了進一步的生物學活性評估以及機制驗證。YB-3-17能明顯抑制mTORC1/2復合物並降解GSPT1,顯著抑制其下遊蛋白的磷酸化水平,並且呈現出良好的時間和濃度依賴性(圖2A)。YB-3-17能夠在低至10 nM的濃度下有效降解GSPT1,DC50僅5 nM。此外,rescue競爭性實驗表明YB-3-17誘導GSPT1降解依賴於泛素蛋白酶體系統(圖2B)。研究人員還測試發現YB-3-17對mTOR的酶活IC50僅為0.22 nM,甚至略優於抑制劑MLN0128(IC50= 0.47 nM)(圖2C)。同時,研究人員發現YB-3-17能夠有效抑制多種神經腫瘤細胞的增殖,IC50值低至3.3 nM(圖2D),優於單靶點mTOR抑制劑(MLN0128)、GSPT1降解劑,以及它們的聯合治療(圖1D),顯示出作用於雙靶點的協同效應。
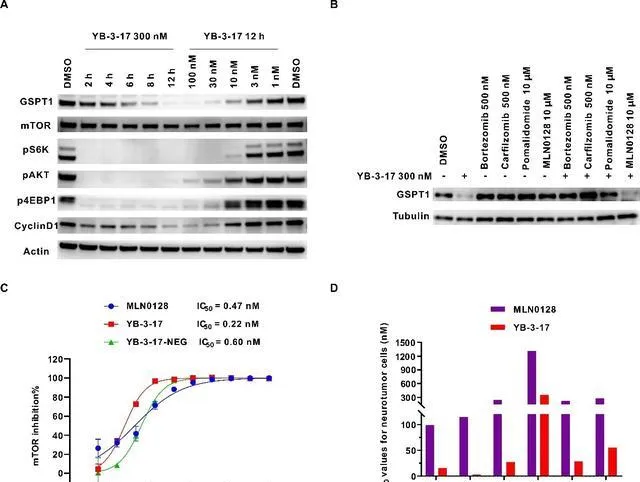
圖2.雙靶雙機制小分子YB-3-17的活性評估及機制驗證
研究人員對YB-3-17選擇性進行了進一步的詳細評估。透過蛋白質組學和激酶譜實驗表明了YB-3-17同時具有優良的GSPT1降解和mTOR抑制選擇性(圖3A, B, C)。基於此,研究人員還做了一個初步的體內實驗對YB-3-17的安全性進行了測試(圖3D)。30mg/kg的mTOR抑制劑MLN0128給藥一次會導致小鼠死亡,10mg/kg的MLN0128連續給藥三天則導致小鼠體重顯著下降。與之相比,30mg/kg的YB-3-17連續給藥三天小鼠依然狀態良好,表明YB-3-17具有較高的體內安全性,也進一步反映出其優良選擇性。
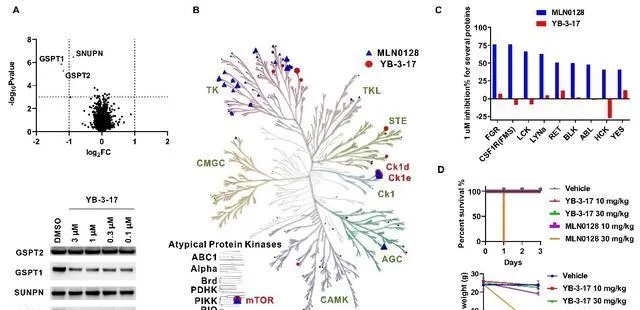
圖3.雙靶雙機制小分子YB-3-17的選擇性及安全性評估
最後,研究人員評估了YB-3-17在小鼠模型上的體內抗腫瘤活性。盡管MLN0128和YB-3-17均顯著抑制了腫瘤生長,然而,YB-3-17在相等劑量下表現出更強的療效,例如2.5mg/kg的YB-3-17產生了與10mg/kg的MLN0128相當的腫瘤抑制效果。值得一提的是,10/20mg/kg的YB-3-17幾乎完全阻止了腫瘤的生長,並導致腫瘤消退,且小鼠狀態良好(圖4B),顯示了YB-3-17在體內強效的抗腫瘤能力及可靠的安全性。與溶媒組相比,YB-3-17顯著抑制了mTOR下遊蛋白的磷酸化,並以劑量依賴的方式降解GSPT1(圖4C)。
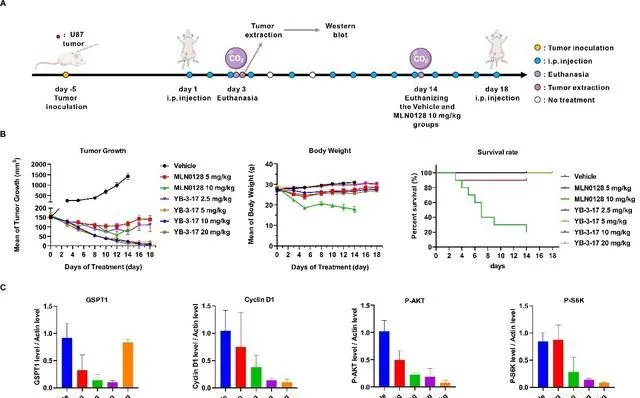
圖4.雙靶雙機制小分子YB-3-17的體內抗腫瘤活性評估
研究人員提出了同時抑制並降解兩種不同靶蛋白的雙靶雙機制小分子設計策略,創新地開發了小分子YB-3-17。該分子能選擇性且高效地抑制mTOR並降解GSPT1。與臨床中mTOR抑制劑MLN0128相比,YB-3-17在體內外的抗腫瘤效果均具有顯著優勢且安全性更佳。YB-3-17以「一石二鳥」特性實作了「事半功倍」的效果,驗證了雙靶點、雙機制策略的可行性,為腦膠質瘤提供了新的治療思路。
相關研究成果以「開發結合抑制和降解的雙靶點雙機制分子膠設計策略」(A dual-target and dual-mechanism design strategy by combining inhibition and degradation together)為題,於12月3日發表於【美國化學會誌】(Journal of the American Chemical Society,JACS)。
清華大學藥學院饒燏課題組2019級博士生劉永波與昌平實驗室副研究員孫秀雲為論文共同第一作者,藥學院教授饒燏與孫秀雲為論文共同通訊作者。研究得到國家自然科學基金委、科技部、昌平實驗室、北京市教委和北京生物結構前沿研究中心的共同資助。
論文連結:
https://pubs.acs.org/doi/10.1021/jacs.4c11930
(來源:藥學院)
來源:北京號
作者:清華大學
流程編輯:U022











