4.13知識分子 The Intellectual

我們需要特別關註特殊人群中的疫苗接種率,需要讓高危人群透過接種疫苗降低重癥風險 | 圖源:http:// pixabay.com
編者按
疫苗接種與新冠死亡風險的關系隨著Omicron疫情的發展已經逐漸清晰。然而,作為特殊人群,如老年人、基礎疾病患者、患有癌癥等嚴重疾病人群、孕婦、孩童等,因擔心接種疫苗安全性問題等疫苗猶豫(註:指個體 「盡管可以接種疫苗,但仍延遲或拒絕接受疫苗」 的行為或心理)而遲遲未能接種,甚至一些醫護人員也因對最新研究不夠了解而不敢推薦,導致新冠感染高風險人群疫苗接種率低於健康人群,重癥和死亡風險增大。
這篇文章詳細介紹了國外mRNA如何在循證醫學基礎上不斷向特殊人群擴充套件,希望能為一些讀者答疑解惑。
撰文 | 周葉斌
責編 | 劉楚
● ● ●
越來越多的研究表明,新冠在老年人、有基礎疾病的人群中危險性更大 [1]。但截至目前,中國老年人群的疫苗接種率卻落後於其他人群和歐美和亞洲一些同樣老齡化的國家。
對於這些特殊人群,新冠疫苗安全嗎?會有效嗎?國外一些疫苗是如何確認能在各個特殊人群裏使用的?它們的推廣有哪些經驗啟示?
1
臨床試驗中專門加入的特殊人群
全球普遍共識是,在一個疫苗上市之前藥企需要透過臨床試驗來確定它的安全性、有效性。其中,三期臨床試驗招募人數最多,也能獲得最充分的有效性、安全性數據。因此疫苗上市時的適用人群需要盡量與三期臨床試驗中的人群類似,或者說在設計與執行疫苗的三期臨床試驗時就要考慮招募誌願者能否代表現實世界中人群不同健康狀況的多樣性,特別是能否涵蓋一些關鍵受眾。
針對新冠來說,我們已經知道老年人的重癥、死亡風險都遠遠高於年輕人,是明確的高危人群。因此從保護高危人群的角度,老年人顯然是新冠疫苗非常關鍵的目標人群。此外,很多老年人同時也患有基礎疾病,能否作為常見基礎疾病患者群體的一部份。 因此,國外一些新冠疫苗在臨床試驗階段就考慮到了老年人與常見基礎疾病患者這兩大人群的招募問題。
以目前全世界使用國家最多的輝瑞/BioNTech新冠mRNA疫苗BNT162b2為例,三期臨床試驗共招募43548人,在獲得歐美緊急使用授權時,疫苗生產商提供的安全性封包括了接種第二針疫苗後跟蹤時間超過2個月的37706人,這其中,55歲以上人群占比42% [2]。
由於在招募時就考慮到了老年人群,BNT162b2在三期臨床試驗裏不僅收集到了充足的老年群體安全性數據,還可以利用亞組分析研究該疫苗在老年人中的有效性數據。
表1中,BNT162b2三期臨床試驗中期分析時65歲以上老人疫苗組有3848人,75歲以上有774人,相比安慰劑組,疫苗降低新冠疾病的風險都與其他年齡段類似,可以證明該疫苗在65歲及以上老年人群以及75歲及以上高齡老人中安全有效。
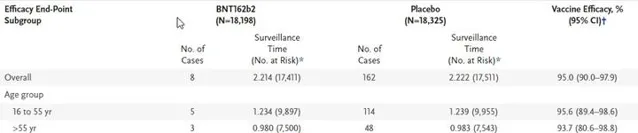
表1 不同年齡段BNT162b2在中期分析時的疫苗有效性[2]
該疫苗臨床試驗招募也同樣考慮到了基礎疾病因素,在BNT162b2的三期臨床試驗中,誌願者中BMI(Body Mass Index,身體質素指數)超過30的肥胖患者約占35%;此外,慢性肺病、心血管疾病、糖尿病等常見基礎疾病在所有誌願者中占比達到20%;同時也有少數癌癥患者、HIV感染者等被招募入組 [2]。
正是由於在三期臨床試驗中有完善的老年人、常見基礎疾病患者數據,BNT162b2等疫苗在國外獲批緊急使用授權時才能安心地把這些高危人群安排在與醫護人員一樣的優先接種順位上,透過盡早接種疫苗來獲得免疫保護,降低新冠感染風險。
2
允許遲到但不允許偷工的未成年人疫苗
疫苗接種的另一個特殊群體是未成年人,一直以來藥企和監管部門對於這個人群的新藥研發都是非常謹慎的。
不同的是,未成年人並不是新冠感染的高危人群,反倒是感染後重癥風險最低的一個群體 [3]。因此,針對未成年人的新冠疫苗研發也走在了後面,甚至在成年人新冠疫苗的臨床試驗成功之後才逐步上馬。
對於未成年人來說,一個很關鍵的問題是該用什麽劑量,是否需要和成年人接種相同劑量和針次的新冠疫苗。輝瑞在BNT162b2的三期臨床試驗時動了點小心思,在原本計劃招募18歲以上受試者基礎上,向美國食品藥品監管局(FDA)提出了一個補充招募16-18歲青少年人群的提議。理由是這個年齡段的未成年人與成年人在各項生理特征上類似,可以考慮使用同一個劑量接種。FDA也同意了輝瑞的提議。
因此,當BNT162b2在美國申請緊急使用授權時,憑借的是一個受試者是16歲以上的三期臨床試驗數據,也因此先一步進入了未成年人群的疫苗施打計劃。
但FDA最後也僅將授權接種疫苗人群的年齡開放降低到16歲,對於更小的孩子,FDA明確要求藥廠重新確立合理劑量,單獨進行臨床試驗。
這些劑量最初都是在少數受試者中嘗試確立的,並在正式獲批前經過了更大規模的臨床試驗來檢驗有效性和安全性。
未成年人新冠疫苗研發與成人不同,這個年齡段感染新冠後很多是輕癥甚至是無癥狀 [3],要在三期臨床試驗裏透過觀察疫苗組與安慰劑組的感染病例差異計算有效性極為困難,需要招募更大規模的受試者,大幅延長試驗時間,並不現實。
為此,目前歐美已上市的幾款新冠疫苗未成年人群的三期臨床試驗大多采用了免疫橋接的設計——即在已知該疫苗在成年人高度有效的情況下,在未成年人群中,只需要驗證疫苗誘發的免疫反應與成年人相似就能推斷出疫苗也有效。
這種設計大幅降低了原本驗證有效性的入組人數要求,但為了明確疫苗安全性,最終試驗所要招募的受試者人數也不少。
以BNT162b2發起的5-11歲兒童臨床試驗為例,藥廠在2021年10月遞交FDA申請該人群的緊急使用授權,提供數據的三期臨床試驗總共入組超過4500名兒童,其中疫苗組3109人 [4]。
這是什麽概念?對於全新的新冠疫苗,FDA的要求是三期臨床試驗裏至少提供3000名疫苗接種者的安全性數據。也就是說,雖然BNT162b2已經做了4萬人的成年人三期臨床試驗,並且在之後幾個月在全球陸續有上億人次接種,而對於這樣一個針對兒童人群的免疫橋接和安全性驗證試驗,臨床試驗數據達到了一個全新疫苗的標準要求。
憑借多重數據,BNT162b2最終獲得了5-11歲兒童組的上市特許。同時,歐美在未成年人疫苗上市後也與成人一樣持續跟蹤疫苗在真實世界裏的有效性、安全性數據。
真實世界數據的研究十分重要,例如mRNA疫苗罕見的不良反應心肌炎,就是在上市後跟蹤確認的。從目前跟蹤數據看,這一不良反應在18-25歲年輕男性接種完第二針後風險最高,但也不超過五千分之一,隨著年齡減少也有所下降,5-11歲男童第二針後心肌炎風險低於十萬分之一 [5]。此外,病例跟蹤顯示此類心肌炎都較為輕微,大部份病例都確認完全康復,風險收益看,已上市的兩個mRNA疫苗的收益都遠大於風險。
目前歐美在未成年人中使用的主要是BNT162b2疫苗,施打劑量在16歲及以上成年人中是30微克一針,而在12-15歲未成年人也繼續采用30微克,但在5-11歲兒童群體裏則降低到10微克一針。
3
臨床試驗中刻意回避的孕婦
如果說未成年人群的三期臨床試驗只是被推遲了,那麽另一個特殊人群則是被臨床試驗刻意回避排除了,那就是孕婦群體。
這種排除也是有原因的。在臨床試驗階段的藥物,研究者對其安全性的了解是有限的,每個參與臨床試驗的誌願者都需要簽署協定承擔一定的風險。從倫理角度看,研究者不會把孕婦這樣的特殊人群加入到最初的三期臨床試驗中,而是需要在一般人群中獲得足夠的安全性數據後,再考慮是否要在孕婦群體中開展新的臨床試驗。
因此,包括BNT162b2在內的新冠疫苗研究者,在設計三期臨床試驗入組標準時都把孕婦群體排除在外。但由於兩個mRNA疫苗三期臨床試驗招募的人群規模非常大,有少數受試者在進入試驗後發現懷孕,這些少數孕婦在試驗的跟蹤過程中發現沒有任何意外情況,成為mRNA疫苗在該特殊人群中最早期的安全性數據 [6]。
但這種極有限的數據量顯然無法作為在孕婦中大規模推廣疫苗的支持證據。為此,在最初的三期臨床試驗成功後,輝瑞、Moderna都宣布會招募孕婦受試者做獨立的三期臨床試驗,提供更充分的安全性、有效性數據 [7]。
事實上,當新冠疫苗在歐美上市之初,醫護人員都被推薦作為第一優先接種順位,而該人群中就有處於孕期的女性。考慮到一線的女性醫護工作者有較高感染新冠的風險,孕婦又是新冠高危人群,因此當時歐美各個衛生部門的做法是持 「中立態度」 ——既不像其他人群一樣明確推薦接種,但也允許她們自願接種。
在推薦指南中不明確表態並不代表 「不作為」,包括美國疾控中心 (CDC) 在內的歐美各國公共衛生部門專門開展了針對接種新冠疫苗的孕婦群體的安全性追蹤研究。
美國CDC專門為新冠疫苗建立了一個名為 「v-safe」 的安全性跟蹤系統,疫苗接種者可以直接上報各種身體不適狀況。兩款mRNA疫苗在歐美上市後僅幾個月後,研究人員就透過分析v-safe等疫苗安全性跟蹤系統中孕婦的足量數據,發現接種疫苗的孕婦沒有出現異於常人的不良反應,在妊娠、分娩等各方面的數據也無異常 [8]。
這類現實世界中的及時跟蹤研究,大大增進了我們對孕婦群體接種疫苗的安全性認知,也成為美國CDC、美國婦產科學會等在後續明確推薦孕婦接種新冠疫苗的決策依據 [9]。
如今看來,在自願接種基礎上獲得的孕婦群體真實世界數據極為關鍵。由於參與三期臨床試驗存在成為安慰劑組的風險,輝瑞等藥企招募孕婦做三期臨床試驗異常困難,入組速度遠低於預期 [10]。因此,如果沒有上述真實世界這些完善的疫苗安全性跟蹤研究,我們可能會長期缺乏新冠疫苗在孕婦中的安全性數據。
後來更多的跟蹤研究陸續表明,孕婦接種疫苗不僅是安全的,還大幅降低了感染新冠後重癥的風險 [11] ,最近還有研究數據指向,孕期接種疫苗後新生兒也能因抗體透過胎盤的轉運獲得一定程度的保護 [12] 。
令人遺憾的是,即便是在公共衛生部門大力鼓勵孕婦接種新冠疫苗的歐美國家,相較普通人群,孕婦群體的疫苗接種率顯著偏低:蘇格蘭的一項研究表明,2021年10月分娩的婦女中僅有32.3%接種了兩劑疫苗,不足所有女性疫苗接種率的一半 [11]。疫苗猶豫讓很多準媽媽面臨著極高的新冠重癥威脅。
4
為脆弱人群提供更好的保護
除了老年人、常見基礎疾病患者、未成年人與孕婦,另一個疫苗猶豫嚴重的群體是患有一些嚴重疾病的人,例如癌癥患者普遍擔心能不能接種新冠疫苗。
很多患有這類嚴重疾病的患者及家屬,往往會問對於他們這個群體疫苗是否安全,甚至希望透過檢索找到專門針對他們這個具體疾病的人群三期臨床試驗數據,才能確認疫苗安全。
需要指出的是,這種常見誤解沒有註意到臨床試驗很難面面俱到,但很多情況是可以讓特殊人群參考借鑒。
由於三期臨床試驗的招募人數畢是有限的,達到每種疾病都能單獨分析的程度並不現實。而且一些臨床試驗涉及很多繁瑣的安全性、有效性跟蹤,需要記錄大量數據,誌願者的配合度要求非常高。這也意味著,一些身患重病,如正在接受高強度癌癥治療的人是不適合參與新冠疫苗的三期臨床試驗的,因此研究人員也盡量排除受試者同時接受其他治療的可能性,防止對試驗有效性、安全性數據的幹擾。
但這並不意味著疫苗對這些脆弱人群不安全。有兩點可以考慮:第一,輝瑞和Moderna的兩個mRNA疫苗臨床試驗都不只招募了健康人群參與試驗,受試者本身有很多是有基礎疾病的,雖然這些人未必和某個猶豫能否接種的人患的是一模一樣的疾病,但顯然可以說明疫苗不是只在健康人群中安全;第二,現在輝瑞/BioNTech的mRNA疫苗等新冠疫苗在全世界接種人數已經達到數億規模,全球各地的安全性跟蹤研究都沒有顯示某個疾病的患者出現安全性問題,如此大規模已接種人群中,我們能想得到的大多數病種大概率都有了安全接種的記錄。
所以,包括癌癥患者、血透患者等特殊脆弱人群,並不需要擔心疫苗的安全性問題。目前在歐美,上述人群也都排在是公衛部門推薦接種新冠疫苗的優先順位。
相比安全性問題,上述人群真正需要擔心的是由於免疫抑制 (immunosuppression,指對於免疫應答的抑制作用) ,疫苗可能在他們身上效果不夠好。
因此,歐美很多公衛工作人員、疫苗接種計劃制定者、醫務人員與科研人員, 更為專註的研究問題是如何提高這些脆弱人群的疫苗有效性。
例如,美國CDC在2021年8月發表的一項研究,總結了60多項免疫抑制人群中mRNA疫苗的免疫反應,發現這些人群的抗體轉陽率與抗體滴度明顯低於對照組的健康人 [13]。而這些脆弱人群一旦感染新冠,重癥風險又很大。為此,歐美目前普遍采取的措施是讓免疫抑制人群在接種完第二針mRNA疫苗一個月後再次接種第三針來提高保護。在完成三針全程接種之後,在再與其他人群一樣,3-6個月之後再次接種增強針。
甚至,歐美一些已開發國家最近開始為部份人群接種第二劑增強針,其中除了老年人群,就有包括癌癥患者、血透病人、器官移植人員、自身免疫疾病患者等免疫抑制人群。
5
中國如何借鑒
總結一下,目前歐美各國在疫苗接種指南上,除了重癥風險低的低齡孩童,其他特殊人群如老年人、基礎疾病患者、患有嚴重疾病如癌癥的脆弱群體、孕婦、5歲以上孩童等,都是強烈推薦接種並優先提供接種機會。
在中國面對傳染性極強的奧米克戎BA.2突變株挑戰的今天,我們需要特別關註特殊人群中的疫苗接種率,需要讓高危人群透過接種疫苗降低重癥風險。
中國老年人新冠疫苗接種率偏低,截至2022年3月17日,60-69歲老人完成全程基礎免疫的比例是86.6%,完成加強免疫的比例是56.4%。70-79歲老人的數據是81.7%和48.4%。80歲以上高齡老人則更低,僅有50.7%和19.7% [14]。
這其中,很多患有基礎疾病人群存在疫苗猶豫以及因各種原因無法接種的情況,導致他們在面對新冠疫情時風險極高。參考國外在各種特殊人群中推廣疫苗的經驗,我們能得到什麽啟示?
第一,也是最重要的一點是尊重數據。 疫苗的推廣,包括在某個人群做出什麽程度的推薦,是強烈建議還是中立允許抑或是暫緩,都要基於真實的數據。這個數據可以有各種來源,可以是臨床試驗,也可以是在現實世界裏的跟蹤,或者是二者結合。
像老年人與有基礎疾病的人群,歐美一些疫苗在三期臨床試驗裏就收集到了足夠的安全性有效性數據,一開始就強烈推薦接種。未成年人不是高危人群,就等到相關臨床試驗數據充分的情況下再推薦。孕婦臨床試驗數據缺乏,但透過真實世界跟蹤,數據收集夠了,也從中立轉為強烈推薦。 只有足夠的數據,推薦時才能有理有據;沒有足夠的數據,空口推薦接種是無法服眾的。
第二,疫苗的數據是不斷積累的,推廣疫苗接種時也要跟上腳步。 例如BNT162b2在三期臨床試驗總共招募入組4.4萬人,這在所有新冠疫苗三期臨床試驗裏是最多的,受試者多樣性程度也很高。但即便如此,這個疫苗的數據收集並不止步於一個三期臨床試驗,獲得緊急授權接種後,藥企與監管機構一直在現實世界裏開展跟蹤接種者的安全性、有效性研究。在成年人群獲得授權後,為了推廣到未成年人,藥企也是在與監管機構高效溝通的基礎上,確立完善的試驗計劃,在不影響數據質素的前提下盡快驗證疫苗的有效性、安全性。
中國很多老年人、基礎疾病人群接種疫苗非常猶豫,其中一個擔憂就是疫苗沒有在類似人群裏做臨床試驗,無法確認其安全性。這其實是一種誤解。
國內施打最多的新冠滅活疫苗,最初的三期臨床試驗確實以招募醫務人員為主,缺少高危人群數據。但隨著在海外多個國家如巴西、智利、土耳其大規模人群接種套用,也因此收集到了大量高危人群中的數據。例如,2021年9月發表的一項研究已經顯示新冠滅活疫苗在老年人與有基礎疾病的人群中是安全有效性的 [15]。
除了接種疫苗的人群自身,相關醫務人員在推廣疫苗接種時需要跟上這些數據的更新。有些情況下,老年人、有基礎疾病的人自己想接種,反而是負責接種的醫務人員由於沒有獲得最新的滅活疫苗真實世界研究數據更新,不願擔責因此不敢打。
上述這些情況都是非常令人遺憾的, 公共衛生部門需要把疫苗的最新數據及時更新公示出來,及時向醫務人員、普通大眾科普,才能有效提高疫苗接種的效率,降低高危人群感染風險。
第三,沒有一個疫苗是完美的。 在不斷研究、跟蹤疫苗的有效性、安全性時,不可能每個結果都符合我們預期。
比如說在免疫抑制人群裏,被認為免疫原性非常好的mRNA疫苗,也會出現激發的免疫反應不足,出現接種防止感染、重癥、死亡的效果不好的情況。但這些數據同樣是非常重要的發現,只有看到這種「糟糕」的結果,公衛部門才能調整接種方案,透過增加疫苗接種,以及使用其他防護措施,讓免疫抑制的高危人群獲得足夠的保護。
同樣的,mRNA疫苗在現實世界的跟蹤裏也發現了極罕見的心肌炎不良反應,腺病毒疫苗也有極罕見的血栓風險。 任何一個疫苗都無法完全排除有罕見的嚴重不良反應風險,但只有堅持不斷跟蹤疫苗的安全性,才能把這些問題找出來,做真正的收益風險分析,給出更為有利於人群健康的接種建議。
最後,良好的資訊溝通渠道非常重要。 從歐美的經驗來看,老年人與基礎疾病人群中疫苗接種率已經較高,但孕婦和未成年人群則表現較差。這種差異很可能與公眾溝通的效果有關。在老年人與基礎疾病患者中,歐美公衛部門在闡述新冠的風險上做得更為到位,制定接種計劃時也有很多傾斜扶持,例如會采取外派醫生到養老院就地提供接種等積極措施。
而在孕婦與未成年人中,一些反疫苗組織的陰謀論卻占據了不少社交媒體空間。如何應對關於疫苗副作用的各種謠言以及破解疫苗猶豫,今後將是各國公衛部門都要正視的危機。
同樣的,中文社交媒體上也有很多反疫苗的謠言,國產疫苗在一些特殊人群如孕婦、癌癥患者中的安全性有效性數據也較少被宣傳。這些因素都合並導致上述特殊人群的疫苗接種率更低。
面對各地新冠Omicron疫情的危機,我們需要提醒高危人群,接種疫苗來獲得保護刻不容緩。而這篇文章,希望能給決策者一些參考,我們需要用一個疫苗最全面、最真實的數據來說服那些存在疫苗猶豫、還不確定自己能否接種疫苗的人。
【知識分子】專欄作者
阿拉巴馬大學伯明翰分校博士,現就職於藥企從事新藥研發工作,業余寫寫科普,微信公眾號:一個生物狗的科普小園。

周葉斌
參考文獻: (上下滑動可瀏覽)
[1]Vaccine effectiveness of two and three doses of BNT162b2 and CoronaVac against COVID-19 in Hong Kong Martina E. McMenamin, Joshua Nealon, Yun Lin, Jessica Y. Wong, Justin K. Cheung, Eric H. Y. Lau, Peng Wu, Gabriel M. Leung, Benjamin J. Cowling medRxiv 2022.03.22.22272769
[2]https://www. nejm.org/doi/full/10.10 56/nejmoa2034577
[3]https://www. cdc.gov/coronavirus/201 9-ncov/hcp/pediatric-hcp.html
[4]https://www. fda.gov/media/153510/do wnload
[5]https://www. cdc.gov/vaccines/acip/m eetings/downloads/slides-2022-01-05/02-COVID-Su-508.pdf
[6] https://www. nejm.org/doi/full/10.10 56/nejmoa2035389
[7]https://www. pfizer.com/news/press-r elease/press-release-detail/pfizer-and-biontech-commence-global-clinical-trial-evaluate
[8]https://www. nejm.org/doi/full/10.10 56/nejmoa2104983
[9]https://www. cdc.gov/coronavirus/201 9-ncov/vaccines/recommendations/pregnancy.html?s_cid=10484:covid vaccine for pregnant:sem.ga:p:RG:GM:gen:PTN:FY21
[10]https://www. wsj.com/articles/pfizer -study-of-covid-19-vaccine-in-pregnant-women-delayed-by-slow-enrollment-11632310283
[11]https://www. nature.com/articles/s41 591-021-01666-2
[12]https://www. cdc.gov/mmwr/volumes/71 /wr/mm7107e3.htm?s_cid=mm7107e3_w
[13]https://www. cdc.gov/vaccines/acip/m eetings/downloads/slides-2021-08-13/02-COVID-Dooling-508.pdf
[14]https:// m.guancha.cn/politics/2 022_03_19_630969.shtml
[15]https://www. nejm.org/doi/full/10.10 56/NEJMoa2107715
制版編輯 | 姜絲鴨










