近年來,帕瓦羅蒂、沈殿霞、喬布斯等重量級名人相繼因為胰臟癌去世,不得不引起大眾的廣泛關註。就連小編也曾遇到過朋友詢問親屬患有胰頭癌後,到底有沒有新治療藥物或技術能夠提高生存期。
5年生存率僅為10%,「萬癌之王」何其兇險!
癌王之爭一直都是個經久不衰的話題,要說起「癌王」,胰臟癌當之無愧。它是一種主要起源於胰腺導管上皮及腺泡細胞的惡性腫瘤,惡性程度極高,起病隱匿,早期診斷困難,進展迅速,生存時間短,是預後最差的惡性腫瘤之一。
據胰臟癌行動網絡(PanCAN)統計,胰臟癌是美國與癌癥相關的第三大死亡原因,僅次於肺癌和大腸癌,且有望在2030年成為僅次於肺癌的第二大死因。2019年中國國家癌癥中心數據顯示,胰臟癌位列中國惡性腫瘤的發病率第10位,惡性腫瘤死亡率的第6位。在男性和女性腫瘤相關死因中居於第6位和第7位。
胰臟癌患者往往在被確診時, 只有20%的人處於早期或中期,這意味著約有80%的患者沒有機會救治,5年生存率僅有10%,預測2030年胰臟癌死亡率將僅次於肺癌。 在很多人眼中看來,這無疑就是宣判了「死刑」,生命開始倒計時!

CAR-T療法進軍實體瘤,胰臟癌首當其中
面對如此「窮兇極惡」的胰臟癌,醫學研究者們並沒有氣餒,而是將目光投向近幾年來的熱門療法——嵌合抗原受體T細胞免疫(CAR-T)療法。
眾所周知,CAR-T在治療惡性血液學腫瘤方面取得的成果有目共睹,然而CAR-T在實體瘤方面的成績卻乏善可陳。就在最近幾年,已有研究表明,CAR-T療法的成功已經延續到實體瘤範疇,其中以胰臟癌首當其沖。
據無癌家園小編查閱眾多臨床研究發現,間皮素(Mesothelin)、CD133、PSCA、Claudin 18.2、HER2等靶點是CAR-T治療胰臟癌的熱門靶點,那麽今天就為各位癌友們詳細介紹下相關的臨床研究,以供參考。
01
間皮素(Mesothelin,MSLN)
間皮素是一種腫瘤相關抗原,在上皮樣間皮瘤、胰臟癌、卵巢癌、膽管癌和胃癌等多種惡性腫瘤細胞上過表達,而在大多數正常組織中幾乎沒有表達。
國際知名雜誌【Journal of Hematology & Oncology】刊登了中國醫學研究者們的一項成功改造CAR-T技術的臨床研究,研究中提及的CAR-T產品選擇的靶點有 mesothelin(MSLN,又稱為間皮素,可以套用於多種上皮癌癥,比如惡性間皮瘤、胰臟癌、胃癌、卵巢癌等)。
其中1例晚期胰臟癌患者,接受的是靜脈回輸的CAR-T治療,治療後全身的病竈,基本都實作了代謝活性完全消失。
典型病例
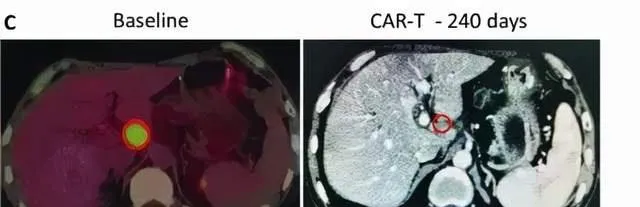
受試者GD-G/M-005 是一例具有 MSLN 表達的晚期胰臟癌患者。該受試者進展為局部淋巴結轉移(24×33 mm)(圖c)。抗 MSLN-7 × 19 CAR-T 細胞首先透過肝動脈輸註,當晚伴有高燒,沒有細胞因子釋放症候群 (CRS) 或神經毒性。隨後,他每1~2個月接受一次抗 MSLN-7×19 CAR-T 細胞的靜脈輸註。
直到增至CAR-T細胞輸註的5倍,CT分期顯示 他在治療240天後達到完全緩解, 測定的淋巴結為8.3×9.6mm, 並未見其他腫大的淋巴結 (圖C), 患者此時病竈完全消失,保持正常狀態。
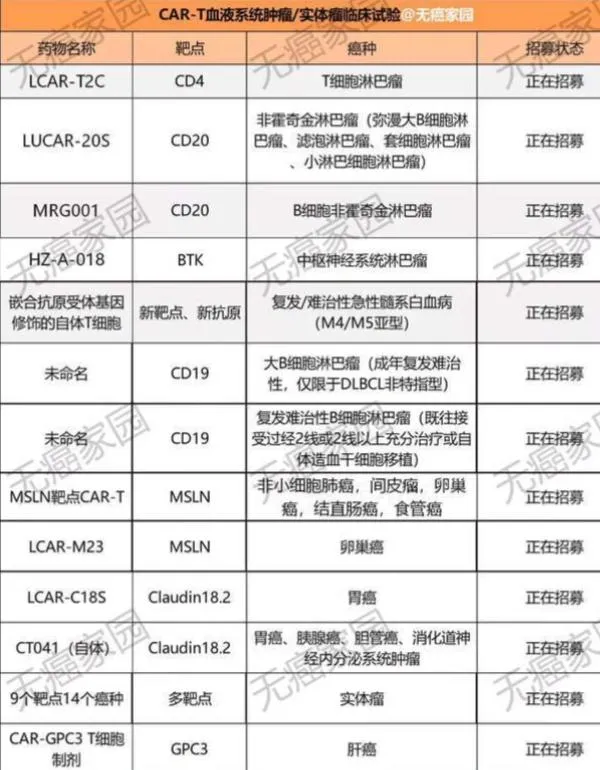
除了胰臟癌的CAR-T臨床招募外,無癌家園還有多款血液腫瘤及實體瘤的CAR-T臨床試驗正在進行招募。
02
Claudin18.2(CLDN18.2)
Claudin18.2(CLDN18.2)位於細胞膜表面,正常情況下表達於胃粘膜分化上皮細胞,在胃腺癌中表達高達70%。此外,CLDN 18.2活化還可見於胰臟癌、食道癌、卵巢癌和肺癌,因此是具有潛力的CAR-T靶點。
基於此,中國研究人員開發了國際上首個針對 Claudin18.2 的 CAR-T 細胞。
2019 ASCO年會上,CAR-Claudin18.2 T 細胞治療胃癌/胰臟癌的臨床數據更新顯示,靶向claudin18.2 CAR T細胞治療12例轉移性腺癌(胃癌7例,胰臟癌5例),未發生嚴重不良事件、治療相關死亡或嚴重神經毒性。11例評估物件中:1例(胃腺癌)完全緩解;3例(胃腺癌2例胰腺腺癌1例)部份緩解;5例病情穩定;2例病情進展;總客觀緩解率為33.3%。
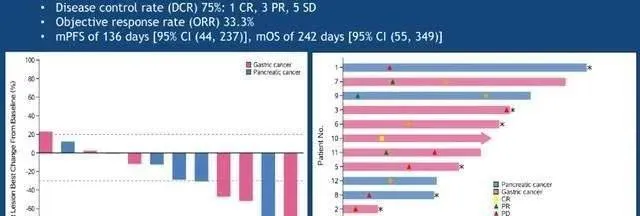
並且,CAR-Claudin18.2 T 細胞治療胃癌的臨床前研究成果顯示,靶向Claudin18.2的CAR-T細胞在小鼠模型中可以完全清除胃腫瘤,且沒有發生脫靶毒性。
9月16~21日召開的歐洲腫瘤內科學會(ESMO)年會上,由科濟藥業開發的靶向Claudin18.2(CLDN18.2)自體CAR-T候選產品CT041展現了其在消化系統腫瘤中的突出療效,可謂是大放異彩!
截止到2021年4月8日,納入的37例CLDN18.2表達陽性的晚期消化道腫瘤患者,其中包括 28例胃癌/胃食管結合部癌 、 5例胰臟癌 和 4例其他類別的實體瘤 , 約84%的患者既往接受過至少2線治療,中位轉移器官數量為3個。
研究數據頗為亮眼!
所有患者的 客觀緩解率達48.6% , 疾病控制率達73% ; 所有胃癌患者總客觀緩解率為57.1%。
相關文章連結:出息了!疾病控制率73%,晚期胃癌患者的新希望!國產CAR-T療法CT041效果驚艷
03
前列腺幹細胞抗原(PSCA)
前列腺幹細胞抗原(PSCA)是一種存在於細胞膜外表面的膜蛋白。它最初在前列腺癌的腫瘤細胞表面被辨識,但後來在包括 胰臟癌、卵巢癌和膀胱癌 在內的多種類別的腫瘤中也被辨識。
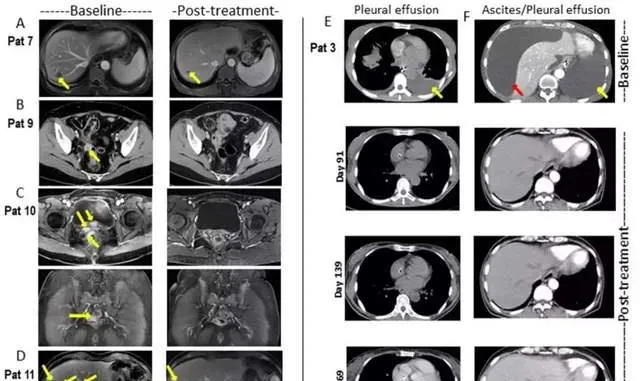
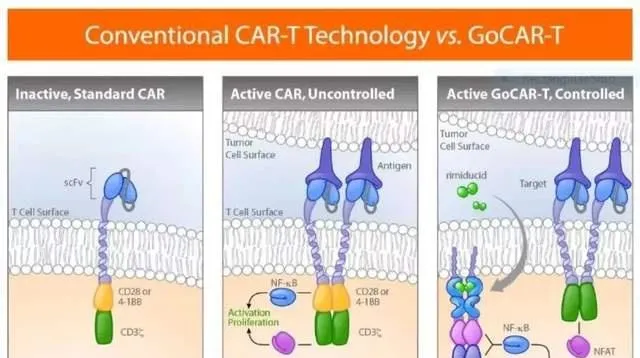
在2019年6月召開的ASCO年會上,Bellicum Pharmaceuticals公司公布了一項針對表達前列腺幹細胞抗原(PSCA)的轉移性胰臟癌患者的1/2期臨床試驗數據。 該公司研制的一種新型的改良GoCAR-T技術——BPX-601,其安全性和活性數據都相當積極。 迄今為止,BPX-601的耐受性良好,劑量限制性毒性未觀察到。
與BPX-601相關的大多數不良事件為輕度至中度,給予或不給予支持性治療均可得到緩解。
盡管臨床試驗設計相對保守,但在研究初期已觀察到激發生物活性的證據!
在13例可評估療效的患者中,8例(62%)病情穩定,有3例患者的腫瘤縮小10%~24%。
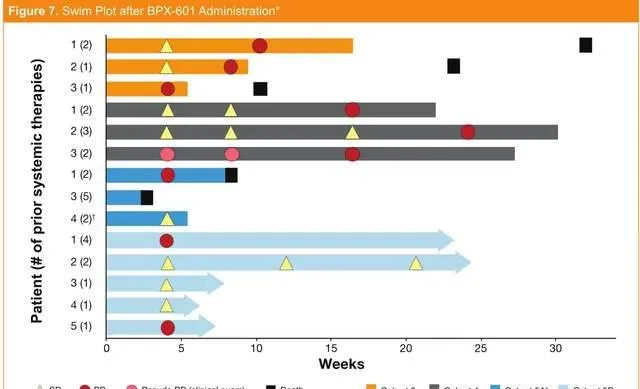
BPX-601給藥後各個患者的療效情況
這家公司董事長兼執行官Rick Fair先生表明這種療法在設計上更為有效,有望突破傳統的CAR-T的局限性,更好地應對實體瘤。
04
CD133
CD133是胰臟癌中的另一個靶抗原,它是一種與癌癥幹細胞相關的跨膜糖蛋白,在多種實體惡性腫瘤如 肝細胞癌、胰臟癌和膽管癌 中表達。
此外,由於腫瘤幹細胞是參與轉移和腫瘤復發的細胞,CD133過表達已被證實與不良預後有關。
在一項I期臨床試驗中檢測了靶向CD133的CAR-T細胞治療胰臟癌的效果。該研究共納入23例癌癥患者,其中胰臟癌7例,結腸直腸癌2例,肝癌14例。
所有患者的客觀緩解率為13%,3例患者達到部份緩解,中位無進展生存期為5個月,6個月總生存率為35%。
肝癌患者的客觀緩解率為7%,1例患者達到部份緩解,中位無進展生存期為7個月,6個月總生存率為43%。
安全性方面,幾乎所有的患者都經歷了血紅蛋白、淋巴細胞和血小板的減少。血液毒性一般發生在細胞輸註後3~5天,並在1周內自行恢復。
05
HER2
HER2是表皮生長因子受體家族的一部份,在細胞的生長和分化中起著不可分割的作用,在乳癌、胰臟癌、膽管癌、卵巢癌、子宮內膜癌、胃癌等多種癌癥中過表達。
在一項I期臨床試驗中,研究人員使用HER2特異性CAR-T細胞治療HER2陽性的胰臟癌和膽管癌。
11名HER2陽性晚期膽道癌和胰臟癌患者參與了這項試驗。所有患者的治療反應均可評估。 1例達到部份緩解,5例疾病穩定, 其余5例有疾病進展。3例患者發生了與CAR-T細胞治療相關的3級不良事件,1例為急性發熱伴寒顫,1例為轉氨酶升高;此外還有3例患者出現嚴重3級上消化道出血,轉移竈侵犯胃竇。大多數患者出現CAR-T細胞療法相關的1級或2級不良反應。總的來說,這些患者對治療的耐受性良好。
除了上述報道的國際CAR-T突破性臨床研究外,當前套用CAR-T治療胰臟癌的臨床試驗靶點還有EGFR、EpCAM、MUC1、CEA、CD24、BCMA等正在臨床試驗中。
CAR-T療法的獲批將為中國患者帶來更多臨床獲益
阿基侖賽註射液、瑞基奧侖賽註射液的紛紛獲批上市,首先對符合其適應癥的患者又增加了一種新的治療選擇,也就多了一份治愈的希望。
其次,這兩次的獲批意味著CAR-T療法已經被國內環境所接納,未來更多CAR-T產品或適應癥的研發及審批都將得到提速。
經過近30年的發展,CAR-T細胞療法已然興起,該領域不會孤立的發展。目前已經有一些試驗表示,很可能最好的腫瘤響應需要特異性的CAR-T療法結合小分子治療、免疫調節、化療和基於抗體的治療等多種治療的協同作用,這些試驗不提供特定的CAR,而是針對一些可能的抗原靶點設計CAR,這些抗原靶點取決於病人疾病的免疫表型。
在個人化醫療的時代,無論是單一療法還是聯合療法,CAR-T無疑是醫藥領域火熱的研究物件,希望今後能夠取得更多突破,在血液腫瘤和實體瘤的治療上展現其獨特的實力!











