原创 存在一棵树 图灵基因 今天
收录于话题 前沿分子生物学机制
撰文:存在一棵树
IF=42.778
推荐度:⭐⭐⭐⭐⭐
亮点:
1、建立了一种与癌基因相关的多色报告小鼠模型——Red2Onco,可允许对同一组织中的突变型和野生型细胞进行差异追踪;
2、利用Red2Onco系统,在小肠中发现癌基因驱动的旁分泌重构,从而创建一个不利于野生型组织的维护但可促进癌组织发展的微环境。

2021年6月2日剑桥大学MRC剑桥干细胞研究所博德研究所
Bon-Kyoung Koo
与
Benjamin D. Simons
联合在
【Nature】
上发表了一篇名为「
Tracing oncogene-driven remodelling of the intestinal stem cell niche
」的文章。该研究展示了一种与癌基因相关的多色报告小鼠模型——Red2Onco,其允许对同一组织中的突变型和野生型细胞进行差异追踪,该研究团队将其应用于小肠,发现表达癌基因的突变隐窝改变了邻近野生型隐窝的细胞组织,从而加速了克隆漂移。

肿瘤微环境 (TME) 构成了一个复杂的生态系统,其中包括其中包括突变型和野生型(WT) 细胞,以及内皮细胞、免疫细胞和间充质细胞;在肿瘤形成的初始阶段,TME接收来自肿瘤细胞的信号,从而发生改变。目前对于TME改变如何影响非恶性细胞知之甚少。
在哺乳动物中,肿瘤发展过程中的细胞竞争越来越受到重视,突变细胞和 TME中的癌基因驱动变化有可能影响邻近的 WT 细胞。如图1所示,研究团队基于Brainbow-2.1的多色 Confetti 报告开发了Red2Onco 系统,该系统允许在 RFP+ 克隆中特异地共表达癌基因。在Cre 激活后,R26R-Red2Onco 构建体随机重组以表达四种荧光蛋白之一,并且只有 RFP+ 克隆共表达致癌 cDNA。
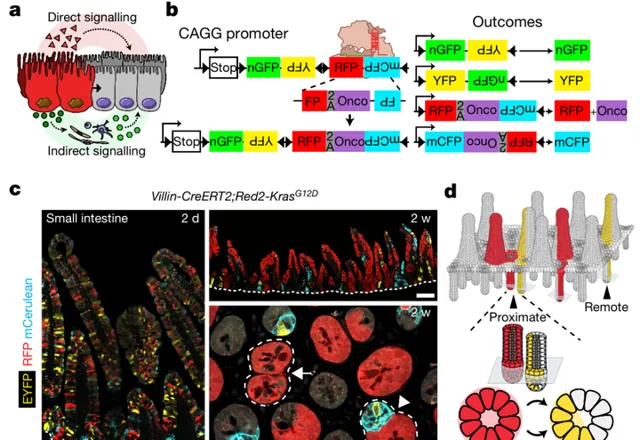
哺乳动物中,小肠由隐窝和绒毛组成,所有吸收和分泌细胞谱系均由位于隐窝基底的肠干细胞 (ISC) 产生;随着 ISC 分裂,邻近细胞从生态位中被取代并进入分化程;最后ISC 衍生的克隆随机扩展和收缩,导致克隆的「中性漂移」,直到它们丢失或隐窝变成单克隆。为了研究突变克隆是否影响邻近隐窝中 WT 克隆的命运,研究团队在Villin-CreERT2 中进行了谱系追踪,发现突变细胞介导了 WT 细胞动力学的变化。如图2所示,对邻近突变体隐窝的隐窝中的 WT 克隆进行进一步的定量评估,发现与Confetti对照相比,靠近突变隐窝的克隆的漂移率大 1.9 倍;而有效干细胞数量的减少导致 WT 克隆在与突变体隐窝相邻的隐窝中加速漂移。
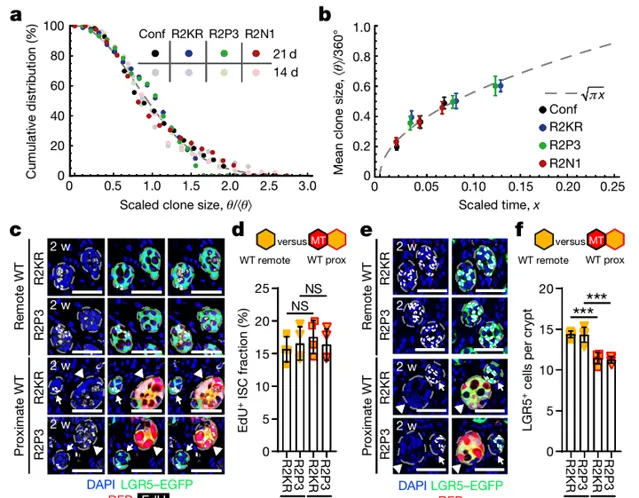
如图3所示,为了定义介导串扰的机制,研究团队利用 Red2Onco 系统的设计进行比较单细胞转录组学,同时对肠进行分离后进行细胞分选。通过细胞分选结果与来自对照的单细胞 RNA 测序 (scRNA-seq) 数据相结合,确认了上皮细胞、基质细胞和免疫细胞中基因表达突变驱动变化的证据,即与突变细胞一样,WT 群体在两种Red2Onco模型中都含有较低比例的干细胞和转运扩增细胞。WNT、RAS-MAPK 和 PI3K-AKT 通路中的突变是结直肠癌的关键驱动因素,基于已有发现,研究团队 专注于BMP 和 WNT 信号的变化,以追踪隐窝间细胞串扰的基础。随后研究团队检查了可能影响 BMP 和 WNT通路的直接(上皮细胞到细胞)和间接(通过间充质或免疫细胞)通信途径。间充质细胞中配体表达的变化增加了在癌基因激活后生态位环境改变的可能性;突变体 KRAS 或PI3K 的上皮癌基因表达诱导了富含 BMP 的信号环境,而PI3K诱导了缺乏 WNT 的环境。
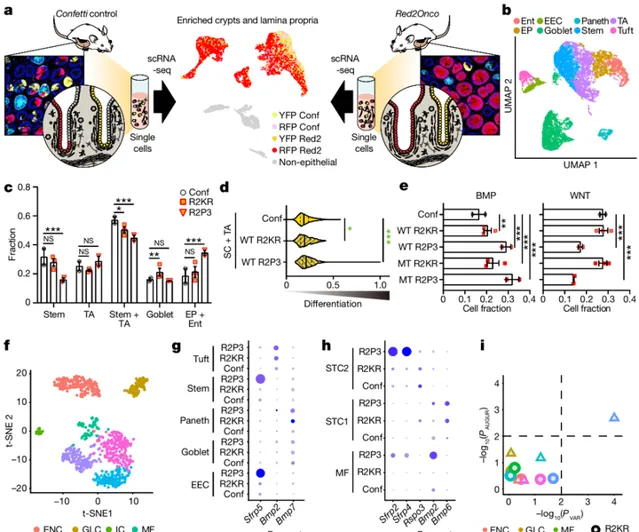
为验证以上发现,我们对分别是 WNT 和 BMP 通路的下游靶基因的Axin2和Id1进行了原位杂交。如图4所示,原位杂交、qRT-PCR 和类器官分析证实了两种 Red2Onco 模型的突变上皮细胞中 BMP2 的表达增加以及体外上皮 BMP 配体的功能,即表明通过长程旁分泌信号,突变细胞也可能直接或通过癌基因驱动的共享生态位环境改变影响相邻域中的 WT 细胞,而生态位重塑可能是致瘤突变体的一般特征。

教授介绍

Bon-Kyoung Koo,博士,
现任奥地利科学院分子生物技术研究所(IMBA)组长。2006-2009年,于韩国浦项科技大学、韩国首尔国立大学师从孔永云教授完成其博士后研究;2009-2013年,在荷兰 KNAW Hubrecht 研究所担任博士后研究员,其导师为Hans Clevers 教授;2013-2017年担任剑桥大学剑桥干细胞研究所组长。其研究方向为成人干细胞的稳态调节;其实验室热衷于研究成体组织稳态的潜在机制和肿瘤发生的早期步骤,通过使用遗传学工具、体内和体外模型以及成像技术的组合,旨在了解稳态组织再生如何受到调节以及致瘤突变如何影响成体干细胞的平衡。
参考文献
1、
Yum, M.K., Han, S., Fink, J. et al. Tracing oncogene-drivenremodelling of the intestinal stem cell niche.
Nature
(2021).











