這個專題中 「陰間」指 「 陰險+見光死(看過答案就不會再上當的意思) 」。本次的主題還是「冷門的考點」。上一篇中有幾個問題太復雜了,篇幅過長,據說現在超過500字沒有配圖的回答,讀者就看不下去,所以拆分了。本章的一些問題爭議很大,所以查了很多資料,拖到了現在。
有時候很多題目的答案不知道的話非常難想到,知道的話寫出來就是滿分。在實驗問題中玩的話,比如玻璃的折射率,特殊的操作方法,在化學理論考試裏也有,化學題裏經常被懷疑的題目則是「冷門元素反應」,以至於一些書上的為了證明題目是正確的會附上實驗現象觀察。
16, 「Fe₂S₃」?
(第21屆高中化學競賽決賽2-4) K₂FeO₄ 在KOH 溶液中可將甲苯氧化成苯甲醛, FeO₄²⁻轉化為棕色沈澱和綠色溶液(綠色是由FeO₃²⁻呈現的),該綠色溶液與適量的S²⁻發生氧化還原反應生成深色沈澱,組分分析發現該沈澱為3種物質的混合物,寫出它們的化學式。

可能現在有人會說這個 三硫化二鐵 很正常啊,我老師講過這個,【xxxx元素化學】上就有,【xxx無機化學】也有,高中化學題裏還有實驗討論,總之很簡單啊…… [1] 這個競賽題出現之後硫離子和三價鐵離子形成黑色三硫化二鐵這個知識點被廣泛傳播,之後還在各種題目中出現。比如有把這個問題改編成了高中實驗探索題的。 [2]
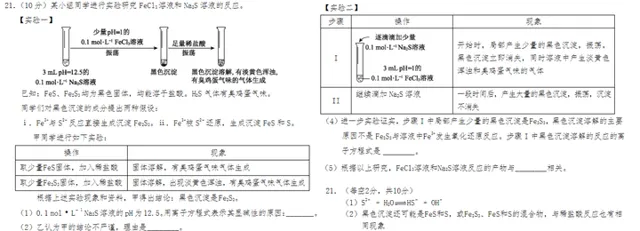
這題被吐槽很多年除了當時這個知識點知道的人不多以外,這題的表述也很有玄機,「綠色溶液與適量的S²⁻ 發生氧化還原反應 生成深色沈澱」有故意誤導考生的嫌疑,總之這題 充滿了惡意 。
先討論一個基礎問題——真的是三硫化二鐵嗎?為什麽三價鐵不氧化硫離子呢?
這要從1995年的一篇Science [3] 講起。很多化學反應因為不知道有什麽用而很少被人研究,過去硫和三價鐵反應形成的黑色無定形沈澱因為不穩定一直缺乏研究,直到鐵硫蛋白相關的研究興起,Fe-S中鐵的價態問題才被關註。這篇文章利用EXAFS技術(擴充套件X射線吸收精細結構譜)發現他們合成的含硫鐵化合物的納米結構中鐵是正三價的,作者表示:
Synthesis of Fe(III) sulfide at the nanometer scale is surprising because most iron sulfides are thought to consist of Fe(II) ions, except for a mixed-oxidation state mineral, greigite (Fe₃S₄). However, there are a few reports of an amorphous Fe(III) sulfide, "Fe₂S₃".(機翻)在納米尺度上合成鐵(III)硫化物令人驚訝,因為大多數鐵硫化物被認為是由鐵(II)離子組成的,除了一種混合氧化狀態的礦物灰巖(Fe₃S₄)。但是也有一些關於無定形鐵(III)硫化物的報道,即"Fe₂S₃"。
文中的「Fe₂S₃」特意用雙引號標出,並說很「surprising」,這是因為在此之前關於Fe(III) sulfide 這種無定形黑色沈澱的報道極少。在此 之前 關於Fe(III) sulfide 的報道是這樣的呢?比如:
1945年的一篇文章 [4] 聲稱合成了ferric sulphide(ferric表示三價鐵),但是20℃以上時就會分解。

1968年的一篇文章 [5] 也認為三價的硫化鐵在室溫下會分解,還給出了分解的產物 Fe₃S₄ + FeS₂ 或者 FeS + FeS₂ 。
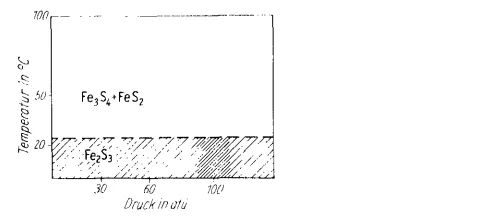
因此過去一般認為Fe₂S₃ 存在但是 在室溫下不穩定,遇水緩慢分解 ,所以教材後面的溶解度表三價鐵+硫離子的那一格是「-」,比如1995年的高級中學課賓·化學一,當時老師給出的解釋便是傳統的「室溫分解說」。

現在其實還是有資料認為「Fe₂S₃」沈澱在水中不穩定,室溫下會分解的 [6] 。但質疑書上寫的不對總是快樂的,Fe₂S₃相關的「打臉文章」很早就有了,比如1983年和1989年就有論文 [7] 想透過實驗證明三價鐵和硫離子形成的黑色沈澱是Fe₂S₃,但確認產物是Fe₂S₃的時候都是利用熱力學數據說明。2001年左右,又有老師質疑當時課本上三硫化二鐵不存在的說法,並用實驗和熱力學計算「證明」了三硫化二鐵存在 [8] 。具體如下:

上面這篇文章是這類「論文」的代表,仔細想想有「先射箭後畫靶」的嫌疑,一是作者在沒有仔細查閱資料,以為高中課本上的「-」是「 明確指出這種物質不存在 」;二是編出了兩個很好反駁的「認為不能制得Fe₂S₃的理由」來反駁;三是認為Fe₂S₃分解會形成硫單質(這一點可能是受八十年代那幾篇的影響),並認為透過實驗沒有硫單質就認為能證明沒有發生氧化還原反應,由此推理得到的是三價鐵;四是認為純粹用熱力學數據可以判斷物質的化合價。

之後把硫離子和三價鐵離子在各種條件下混合,描述實驗現象後用熱力學證明Fe₂S₃存在的論文非常非常多,形成了一個發文章的 套路 ,大概就是賭編輯沒見過類似的文章吧。另外很多文章發現影響實驗現象的因素非常多,原料,pH,氧濃度,溫度都可能有影響。
但我想說,以上論證種最大的問題其實是用熱力學數據的方法不足以證明Fe(III) sulfide/Fe₂S₃ 存在,因為熱力學數據大都是自恰的,Fe(III) sulfide 存在最直接的證據還是1995年那篇Science用的EXAFS,可以用熱力學簡單證明的話Science的作者也不會說他的發現很surprising 了。而且如果熱力學數據來回算算沒問題就證明物質存在,那很多問題,比如四價汞 [9] 是否穩定存在的爭議(理論計算存在,後來有人做實驗認為得到了四氟化汞,再後來實驗被質疑,因此成為爭議),都沒有討論的必要了。

能說明上面這個邏輯有問題的例子就是 CuS ,經常刷知乎的朋友應該知道 [10] ,因為在半導體領域的研究中價態有重要意義,於是衍生出了多種方法,比如前面提過的帶X 的幾個縮寫,就是這些方法證明了硫化銅中銅有+1價的 [11] 。

很多人應該做過這樣的化學題—— 透過能斯特方程式說明因為硫化銅Ksp特別小以至於銅離子不能氧化硫離子,所以形成了二價銅的硫化物 ,但其實很早就有人認為硫化銅中的銅有 部份是+1價或者全部是+1價,總之氧化還原反應肯定是可以發生的 。至於為什麽基礎化學資料上不改,大概因為這個事實除了對半導體之類的研究有影響外,對無機化學分析化學等學科沒有多大意義。同理,三價鐵離子和硫離子到底反應生成了什麽也不重要,像幹法脫硫法什麽的知道三價鐵和硫離子能反應就行了。
現在的變化也就是一些做半導體或量子點的會把硫化銅說成是「CuS型」,避免討論氧化數問題(有人堅持認為正常的硫化銅僅是一價二價混合,而不是完全的一價),或者寫成 \ce{Cu_{x}S} 。
那Fe(III) sulfide中的鐵到底是不是正三價呢?2006年還是一篇礦物學的文章利用NEXAFS和FEFF8計算研究了Fe₂S₃中鐵的氧化數,很可惜的是他們發現這種方法無法區分兩種化合價 [12] ,這類不穩定的無定形沈澱目前除了鐵硫蛋白相關的研究外,也沒有更多的意義。不過他們得出了另一個結論,天然的黃銅礦chalcopyrite是Cu¹¹Fe¹¹S₂ 而不是 Cu¹Fe¹¹¹S₂。
黃鐵礦裏鐵是二價本不是什麽驚人之語,很多書上都采納了這個觀點,但看到這裏一個很自然的想法是「 硫化銅中銅可以是一價的,三硫化二鐵中鐵可以是三價的,那完全可以合成出Cu¹Fe¹¹¹S₂啊 」,還真有人這麽做了 [13] ,得到了「兩種」化合物(應該說是一系列化合物)。
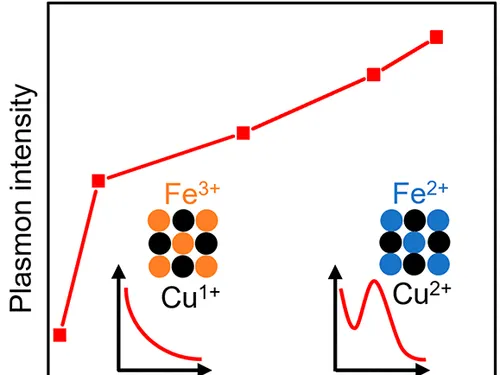
總之一句話,這題純粹是陰險。 [14]
17,成環?
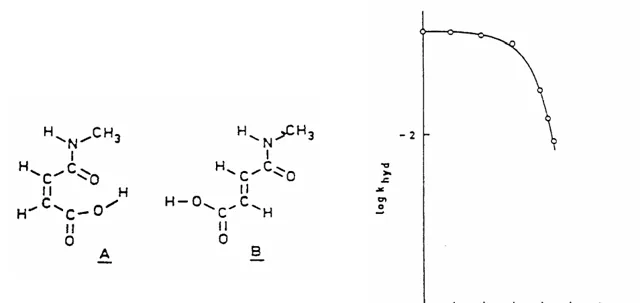
乙酰水楊酸阿司匹林是一種常見的藥物,室溫下pKa=3.49。1950年Edwards 在實驗中發現在pH=4~8時,阿司匹林水解的速率與pH值無關。之後的實驗中發現 [15] ,在富集¹⁸O的水(20%)中重復上述水解實驗,產物中的被¹⁸O標記的水楊酸比例極低,39℃下幾乎未發現,在100℃時僅2%。為上述實驗現象提出一個合理的解釋。
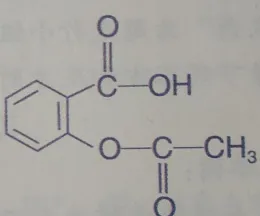
機理題作為一種特殊化學語言的展示,深受機理愛好者的喜愛,但很多時候研究機理的方法因為復雜枯燥,不受待見,形成了只推機理不問證據的現象。另外能出題的機理題套路也很容易總結,比如鄰基參與、正常過程中間插重排等,做多了就很發現套路好像很固定。
但有了討論就有反套路,上面這個機理題便是一個陰險的反套路問題,為什麽說陰險之後在聊,先說說這題再考什麽。這題來自物理有機化學中酸堿催化一節,算是「高級內容」,不過既然可以出給高中生,說明這塊內容沒學過酸堿催化理論應該也能理解。應該很容易就能理解「阿司匹林水解的速率與pH值無關」這句話,轉譯一下就是「 決速步沒有氫離子和氫氧根離子參與 」。
這裏需要一些知識儲備,比如看過一些教材,比如【基礎有機化學】中酯在酸性和堿性下水解的機理,這是會發現題目中後一個中說產物水楊酸中幾乎沒有¹⁸O,再結合pKa=3.49,再結合「決速步沒有氫離子和氫氧根離子參與」的暗示,一個答案呼之欲出,那就是「鄰基參與」。
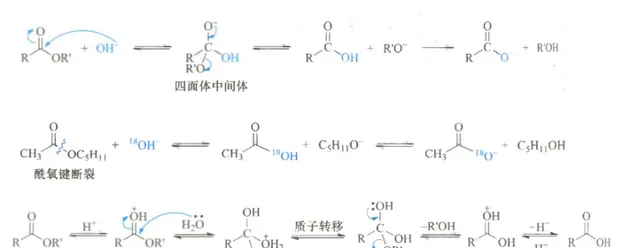
也就是說酯基旁邊羧基參與了反應,它成環了。下面這個機理 似乎 可以解釋題目中的所有現象:
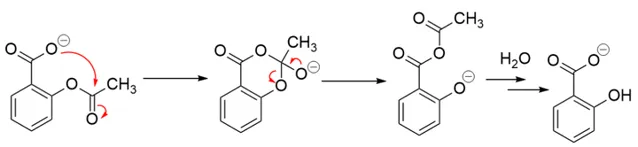
如果直到這裏那這只是一道考鄰基參與的「大路題」,那為什麽要說「陰險」呢?
前面說了這題是物理有機中酸堿催化的例子,沒有見識過相關內容的話這題很難寫出 合理的 機理。而上面這個看起來像這麽一回事的機理並 不合理 ,因為形成酸酐活性很高,在含¹⁸O的水中水解,只進攻一邊是不可能的。
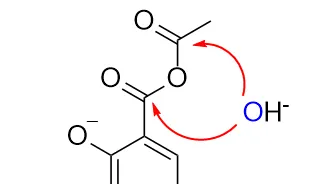
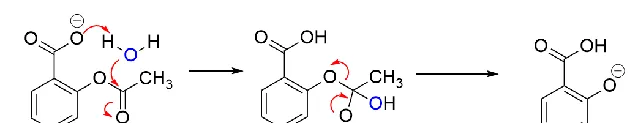
在某種意義上,這個機理也成環了,只不過是更高級的成環,也 更合理一些 。可能有人會覺得上面這個過程不等價於羧酸水解形成的氫氧根水解乙酯基嗎?不等價,動力學和熱力學不一樣,不能「拆反應」。只能說這個「高級內容下放」的問題除了反套路外就只剩下惡心人了。
只能說這種問題沒有把握不應該拿出來惡心人,比如27屆CChO決賽第7題的爭議。
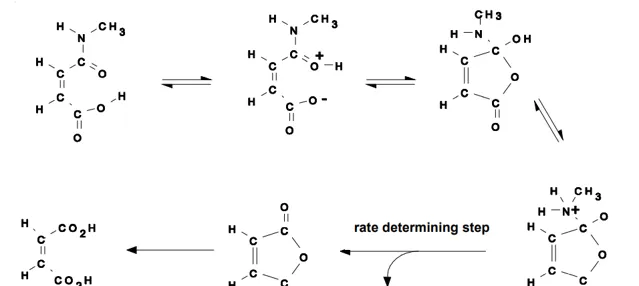
這裏再講一下本題模仿的那道名題——1986年18th IChO第四題。 問題1:醯胺A在39℃,pH=2的條件下水解速度是B的10⁶,為什麽?問題2:39℃下,A的水解速率常數的對數和pH的關系如下,解釋原因。
本題是標準的 鄰基參與 ,第二問和機理有關,後面還有一個同位素方法確定機理的問題,再後面一問就不貼了。這一題在當年絕對算是刁難高中生,但30多年後的今天,類似的考點出現在化學競賽中很多次了,應該不難。
這道IChO題目曾在1988年丁漪教授【大學化學】的文章中討論過,那篇文章開頭說: [16]
國際化學奧林匹克賽題目是一種新型的考題。不少本科生,研究生和教師初次見到考題都感到奇怪,這樣的題目怎麽能指望高中學生來回答。等到他們了解了參賽辦法就會感到,這種考試方法還真有些道理。18,過去的難題
(湖南、雲南、海南1991) A、B是分子量不相等的兩種有機化合物,無論A、B以何種比例混和,只要混和物的總質素不變,完全燃燒後,產生的水的質素也不變。試寫出兩組符合上述情況的有機化合物的分子式,並回答應A、B滿足什麽條件。(相對原子質素 H:1,C:12,N:14,O:16)
m_{水}\propto m_{總}\times x\times \omega_1(H)+m_{總}\times (1-x)\times \omega_2(H)
甲烷乙烷混合物充分燃燒,得到a 體積的二氧化碳和b 體積的水蒸氣,求甲烷乙烷的比例。 或者這麽問, x 體積的甲烷乙烷混合物充分燃燒,求消耗氧氣體積的範圍 。
再看幾個那時的難題體會一下當年的題風。
(1989全國) 將等體積的0.4摩/升乙酸鈉溶液與0.2摩/升硝酸溶液相混和,混和液中各離子濃度由大到小的順序排列為:()
(1991全國) 某化肥廠用氨制備硝酸銨。已知由氨制一氧化氮的產率是96%,一氧化氮制硝酸的產率是92%,硝酸跟氨反應生成硝酸銨。則制硝酸所用去的氨的質素占總耗氨質素(不考慮生產上的其它損耗)的( )。
本題抽樣結果是85%的考生得零分或未回答,可能因為看起來計算復雜而且分也不多很多人放棄了,這題真的不難,就是考一個原子守恒。因此很多資料都覺得這題正確率低得莫名其妙,可能是筆算起來比較復雜。如果現在公務員考試的類似題目一般就像下面這樣速算,看成兩份,一份除上兩個系數,算比例即可。
\frac{\frac{1}{0.96\times 0.92}}{\frac{1}{0.96\times 0.92}+1}=\frac{1}{1+0.96\times 0.92}=\frac{1}{1+(1-0.04)\times (1-0.08)}=\frac{1}{1+1-0.04-0.08+0.0032}
引入近似 \frac{1}{2-0.1168}=0.5\times\frac{1}{1-0.0584}\approx 0.5\times(1+0.0584+0.0584^2+...)\approx0.53
其實膽子大的話,前一步可以直接把0.0032這一項忽略。
19,高級問題裏的坑?
本系列主要討論的是高中和大學低年級的化學題,下面這個來自 晶體生長理論 的熱力學題對基礎知識的要求可能要高一些,但也不難,一些書上介紹納米材料穩定性的時候也會講到:
過冷的熔體(亞穩相)中形成晶核(穩定相)時吉布士自由能的變化可能來源於 自身體積的變化引起的、界面的變化引起的、新形成的相變成舊相引起的 。
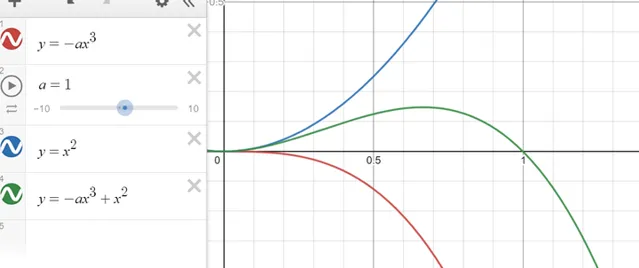
很明顯這個函數有個零點,一般叫做臨界尺寸/半徑r*,小於這個尺寸晶胚生長會導致系統的自由能增加,只有形成的晶核半徑大於r*時,晶胚的生長才能使系統的自由能降低。這其實很好理解,因為符合直覺。當然要註意這是熱力學的結論,所以只能回答能不能,會不會還有考慮動力學。
這個知識點雖然非常「物理」,但一些高級的競賽題裏已經涉及到了。比如下面這個:

等壓條件下理想的固-液系統吉布士自由能和溫度的關系如下圖所示,指出曲線A、B哪一個代表固相哪一個代表液相,並說明曲線交點的意義和為什麽是這種形狀的。(提示:首先證明dG/dT=-S)
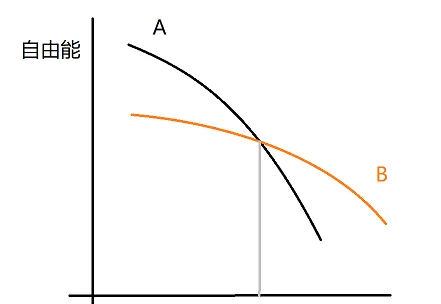
本題非常的簡單,不必管「理想」是有多理想。Tm肯定是凝固點,小於Tm自由能更低的肯定是固體。即使沒想到這一層,提示了dG/dT=-S,B曲線的斜率更小,那也能看出是固體。至於曲線形狀,這裏看成問升降/是否單調+凹凸就好,證明dG/dT=-S 後,這個斜率肯定是負的,至於凹凸,因為溫度越高,熵越大,所以曲線越來越陡,是凸的。那麽這題的坑這哪裏呢?
在證明dG/dT=-S 裏有這麽一個坑,G\equiv H-T\cdot S 不能直接推出dG/dT=-S。但很多大學低年級問題都是假設熵和焓不隨溫度變化而變化的,所以類似的題目裏G-T的曲線會畫成直線,就像下面這樣。受此影響很多用大一無機化學知識硬抗大三物化的同學會中招(右圖是一些依數性解釋裏用的圖)。 [17]
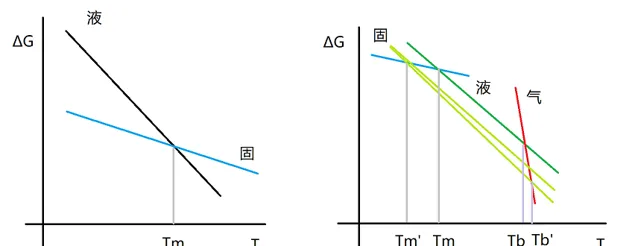
焓熵不隨溫度變化的假設在上面這題裏不成立,因為是曲線,而且要回答「溫度越高,熵越大」這一點,那麽「熵和焓不隨溫度變化而變化」當然不成立,不過硬要說「大曲若直」,在某個溫度附近熵和焓可視為不隨溫度變化而變化,似乎可以,那麽這題怎麽嚴謹地證明dG/dT=-S呢?
因為 dG=-SdT+Vdp ,所以 (\frac{dG}{dT})_p=-S .就是這麽簡單。
也就是說這裏暗考了一個對 全微分 概念的理解,如果理解全微分和偏導數概念自然也知道為什麽假設熵和焓是常數也能證明dG/dT=-S。如果不理解的話可以考慮焓和熵隨溫度變化硬算一下:
\frac{dG}{dT}=\frac{dH}{dT}-S-T\frac{dS}{dT} ,因為是可逆過程,有 dS=\frac{dQ}{T} ,又因為等壓條件,所以dH=dQ。於是前後兩項抵消,得到dG/dT=-S。
這一題已經很接近「熱力學辯經」了,下面這個更難的問題則是考察對熱力學定律的把握。
在恒容恒溫的條件下,晶胚是否和在恒壓恒溫條件一樣,可能出現體積增大的現象 (即在無外力做功的條件下對液相做功的同時自身表面能還增加) ?
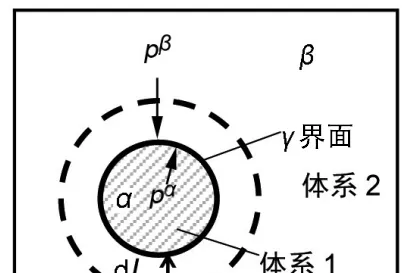
這個問題爭論過很多年了 [18] ,答案和直覺都是 可以 。這個問題想多了反而容易掉坑,恒容恒溫的意味著沒有外力做功,這樣晶胚尺寸變大時豈不是對液相做功的同時自身表面能還增加?這麽一想似乎確實違背了熱力學第一定律。恒容考慮亥姆霍茲自由能,有 dF^\alpha=-p^\alpha dV^\alpha+\sigma dA_s ,其中F是亥姆霍茲自由能,As是表面積。
乍一看確實有問題,但其實因為沒有考慮液相亥姆霍茲自由能的變化。考慮 dF^\beta=-p^\beta dV^\beta=p^\beta dV^\alpha ,的亥姆霍茲自由能能變是 dF=(p^\beta-p^\alpha) dV^\alpha+\sigma dA_s 。
考慮拉普拉斯公式 p^\alpha-p^\beta=\frac{2\sigma}{r} ,按前面的假設把體系想成是個球,有 dV=4\pi r^2 , dA_s=8\pi r ,代入會發現dF=0,所以不違背。
這個問題的坑就是來自開頭的晶體生長模型,回顧本節開頭的理論會發現因為是等壓體系,存在外力做功,不考慮液相也不會給人違反熱一的錯覺,這題考的就是有沒有註意到這個細節。
一個類似的問題是「表面張力永動機」, 下圖中瓶裏裝的是汞,左邊是毛細管,右邊是粗管,根據彎曲液面蒸汽壓公式和連通器規則,氣壓肯定一邊大一邊小,那麽開啟兩個活塞就會出現汞蒸氣源源不斷地湧動的情況。指出以上說法的錯誤之處。 [19]
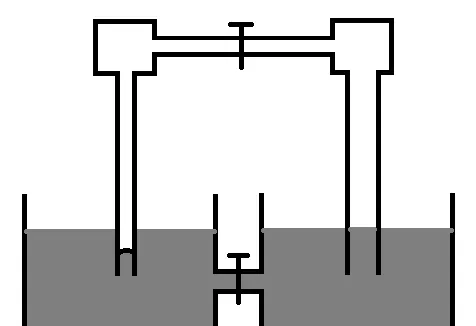
這個問題出在物化試題裏非常刁鉆,出在物理題裏可能還沒那麽難。因為這題錯在沒有考慮 重力 的影響,這題其實透過圖上液面高度的差異暗示了這一點。限於篇幅以上兩個問題完整的計算沒有給出,可以參考參照的文獻。
這大概就是辯經問題的樂趣所在了,不論是第一問的全微分,還是第二問的討論物件範圍問題,或者是最後一問的重力場能否忽略的問題,都是在扣推理過程中的某個近似是否合理。以上推理當然也有可能忽略了一些細節,甚至也有錯誤的假設。這類問題就是扣的這麽細,令人防不勝防。
20,逆向問題
(某校有機化學試題)寫出 下列轉化的反應條件,中間產物不必給出,每個[ ]中只能填入一步反應。
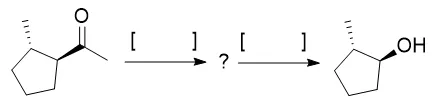
再看一個大學中低年級難度的問題。有的時候出題老師在工作中無意發現了一個巧妙的思路,為了發現這個奇思妙想,他們往往會出一些有著重重限制的問題,迫使同學按著他思路走,上面這個就是這種問題。這種題往往看完答案會感嘆「 他怎麽能註意到,我怎麽就註意不到? 」
上面這題首先要理解一步反應指什麽,可以理解成把原料放進「煉丹爐」裏反應,再加上後各種純化處理是一步,「幾步幾步完成全合成」差不多就是這個意思,這是一個很強的限制。再看題目,做按一般的合成思路合成目標產物肯定是找對應的酮手性催化加氫,這樣比較直接。但看題目的要把乙酰基轉換成羥基,還要求手性不變,這就有些奇怪了。這題實際考的思路是:
這題的問題是這個Dakin氧化反應方法因為原子利用率太低,現在的書上提的不多了,有也不是重點介紹的。雖然Baeyer-Villiger氧化書上還有,但真來這麽一出很難想到。
上面這麽多人名反應羅列在一起不熟悉的朋友可能覺得莫名其妙,下面舉個例子,hydrolysis是水解的意思。
上面的答案涉及了Baeyer-Villiger氧化反應的區域選擇性和手性轉化問題,確實考得細且難了。
前段時間在網上看到了一個來自日本的問題,出題的思路是類似的。
這題的陷阱是容易想到Heck偶聯反應:
可是用硫酸占位後上溴脫保護要三步,加上Heck反應至少四步,所以這個思路不可行。這題的答案非常多,最容易想到的是類似Friedel -Crafts烷基化反應的路線,因為三種常見切斷中苯環可以看成一種「帶負電」的結構,即苯環容易被親電進攻,而後兩種都要在苯環上做文章,就會面臨和上面Heck偶聯一樣的問題。
這題的思路很多,下面是一個可能的答案。
如果要「正常」地合成這個化合物,早期的藥化書上就有了,也沒有很新穎的方法,所以很多習題集有合成這個化合物的問題。
上面這圖其實就有另一個可能可行的思路,受質臭氧氧化得到上面第二步的產物苯丁酸,後面一樣。
往期:
參考
- ^ 就像講08年江西數學高考理科最後一題的影片總有小可愛刷「簡單」「我們班一半做出來了」,我一親戚作為當年的受害者,當年看完答案直接放棄復讀了,不要因此就輕視已經被講爛的問題,很多人其實不知道背後的「解題閃光點」,只是會背。
- ^ 來自2017-2018北京市西城區高三第一學期化學期末試題
- ^ Synthesis and Structure of an Iron(III) Sulfide-Ferritin Bioinorganic Nanocomposite https://www.science.org/doi/10.1126/science.269.5220.54
- ^ R H Grlifth and A R Morcorn. J. Chem. Soc. 1945, 786 (1945)
- ^ ; R Schrader and C. Pietzsch. Z. Chem. 8, 154 (1 968).
- ^https://pubchem.ncbi.nlm.nih.gov/compound/Iron_3_-sulfide
- ^ 蔡惠華. 在Fe^3+與S2^—溶液中反應生物的探討[J]. 福建師大福清分校學報, 1989(2):3.
- ^ 汪富初. 三硫化二鐵的制取方法[J]. 四川職業技術學院學報, 2001(04):57-58.
- ^ Mercury Is a Transition Metal: The First Experimental Evidence for HgF4 https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.200703710
- ^ 有哪些化學上的事實,沒有一定化學知識的人不會相信? - Resazurin Lee的回答 - 知乎 https://www.zhihu.com/question/288033186/answer/459034615
- ^ 下面這篇文章的標題真的太有趣了,想了想還是直接貼出來為好
- ^ The oxidation states of copper and iron in mineral sulfides, and the oxides formed on initial exposure of chalcopyrite and bornite to air https://doi.org/10.1016/j.gca.2006.02.007
- ^ Fe Cations Control the Plasmon Evolution in CuFeS2 Nanocrystals https://pubs.acs.org/doi/10.1021/acs.chemmater.0c03829
- ^ 要找理由的話只能說當年的競賽題就喜歡考這些,算是傳播補正高中化學長期以來形成的盲區,比如2010年初賽第五題,鎂在氮氣中加熱生產灰白色固體,答案是Mg₃N₂,也是爭論過很多年的問題了(另一派觀點是純的氮化鎂是黃綠色固體,含氧化鎂雜質才是灰白色的,所以有時候在網上和別人討論這種爭議問題還是有意義的,說不定會考到)。
- ^https://pubs.acs.org/doi/abs/10.1021/ja00995a007
- ^ 丁漪, 杜爭鳴. 能力的測試——1986年國際化學奧林匹克賽有機考題和預備題分析[J]. 大學化學, 1988(01):49-53.
- ^ 這個假設另一個經常出現的點是基礎化學材料中對吉布士-亥姆霍茲方程式的證明。
- ^ 李愛昌, 趙娣. 關於球形小液滴熱力學公式及其氣液平衡條件的討論[J]. 大學化學, 2017(4).
- ^ 孫德坤. 重力場中的熱力學簡述及其套用. 大學化學, 1995, 10(5).











