抗擊晚期癌癥的路上,每一點成功都來之不易,而且大家都特別希望,這樣的成功是中國學者和國產藥物在中國高發的癌癥治療中取得的,因為這就意味著更新、更好、更實惠的治療方法,能夠很快惠及國內癌癥患者。
最近國產PD-1抑制劑特瑞普利單抗,在一項代號為「JUPITER-02」研究的晚期鼻咽癌一線治療III期臨床研究大考上,交出了一份優異答卷:
特瑞普利單抗聯合標準化療,在多個方面體現比單純化療有更好的療效,能夠顯著延長患者的無進展生存期(PFS),並將患者的疾病進展風險降低48%。
憑借其研究方案的獨特創新,以及在未被滿足的臨床需求領域取得了前所未有的突破性結果,JUPITER-02研究成果成功入選2021年美國臨床腫瘤學會(ASCO)年會,成為全體大會(plenary session)上發表的五項「重磅研究摘要」(Late-breaking Abstract,LBA)之一。
全體大會的LBA一直被學界公認為是該年度最重要、將會改變臨床診療實踐的研究,自ASCO年會有線上官方記錄的十多年來,從未有過本土創新藥研究入選LBA。
而就在今天淩晨,在全球最高級別的癌癥領域學術會議主會場上,JUPITER-02研究的主要研究者
中山大學腫瘤防治中心徐瑞華教授
完成了研究成果匯報,向世界發出了來自中國腫瘤學界的「最強音」。

對於晚期鼻咽癌診療圈的朋友們來說,這實在是個令人激動的訊息,因為這條路上我們「國人當自強」!
一、攻克這種癌癥需要中國人自己的努力
在中國華南地區的廣東、廣西等省份,鼻咽癌的發病率是全球平均水平的20-30倍[1],是發病率最高的地區,根據世衛組織2020年全球癌癥統計報告(GLOBOCAN)的統計,全球新發病例超過13.3萬,約46%的鼻咽癌患者都集中在了中國[2]。
正是因為鼻咽癌在國內多見,在國外罕見,它的治療長期以來並不被國際醫學和科學界重視,國外更重視的是頭頸部鱗狀細胞癌的治療,相關臨床研究往往還直接排除掉鼻咽癌患者。
要滿足中國鼻咽癌患者對新療法的迫切需求,就只能靠中國人自己上。當癌癥治療進入免疫治療、靶向治療的新時代,中國的臨床醫生和本土藥企,都在積極嘗試探索用創新藥物治療鼻咽癌。
除了患者分布上的特殊,鼻咽癌還有一點比較特殊,就是它的治療並不以手術為主,從下面這張圖就能看出,給位於這個部位的腫瘤動手術肯定不容易。而且鼻咽癌是對放療、化療比較敏感的癌癥,早期或局部晚期患者接受放化療綜合治療,5年生存率可以達到70-90%[3]。
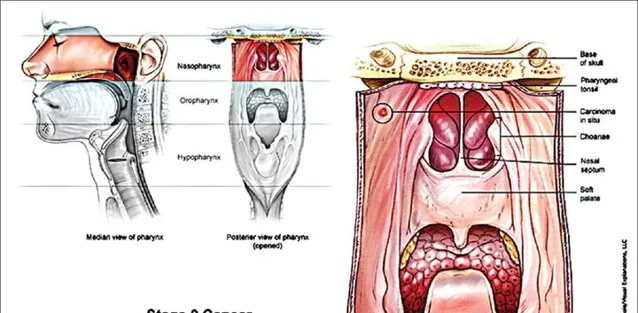
但如果癌癥已經進展到晚期階段,也就是出現了遠處轉移,那麽鼻咽癌患者的5年生存率就只有10-20%了,中位總生存期(OS)不超過20個月[4]。過去除了化療,這個階段的患者沒有其它的治療選擇,而且化療的效果也比較有限。
傳統治療手段都搞不定的難題,只能把希望寄托在「新星」免疫治療身上,相信最近幾年裏,很多患者朋友們都已經有了這樣的觀念。而從理論上來說,鼻咽癌可能也是很適合免疫治療的一種癌癥。
鼻咽癌的發病與EB病毒(EBV)感染高度相關,有病毒感染,免疫系統就會做出反應,來消滅這些侵入人體的外敵。所以鼻咽癌患者的免疫系統,肯定在癌癥發生過程中被啟用過,只是由於種種原因沒能徹底消滅鼻咽癌細胞,讓它們發展成了腫瘤,那麽再一次啟用免疫系統,也許就能有效殺傷癌癥細胞了。
相關科研探索也顯示,鼻咽癌的腫瘤微環境內,其實已經有很多免疫細胞浸潤,其中就包括抗腫瘤免疫的主力——細胞毒性T細胞,而且腫瘤微環境內PD-L1的表達水平也比較高。PD-1/PD-L1通路就是PD-1抑制劑的目標,這就給免疫治療重新啟用免疫系統提供了好機會[5]。
本次取得成功的PD-1抑制劑特瑞普利單抗,此前就已經在臨床研究中不斷向鼻咽癌發起挑戰,並驗證了初步療效:
而且在這些研究中,特瑞普利單抗治療也表現出了良好的安全性和耐受性。
於是,在此前安全性、有效性「實戰」經驗的基礎上,中國研發團隊再接再厲啟動了JUPITER-02研究,率先向著晚期鼻咽癌一線治療發起總攻!
二、PD-1單抗+化療,鼻咽癌一線治療的新選擇
文章開頭就說到過,JUPITER-02研究成果是今年ASCO年會的五項「重磅研究摘要」之一,這也是由中國學者主持、中國研究團隊開展、使用國產抗腫瘤創新藥物治療中國常見癌癥的研究,第一次獲得如此高級別的認可,也說明了該項特瑞普利單抗研究成功的意義重大。
先簡單介紹一下JUPITER-02研究的設計。該研究在中國大陸、中國台灣和新加坡多地的35家中心開展,入組的是確診時就存在遠處轉移,或者是接受根治性治療後復發,但還沒有接受針對復發或遠處轉移腫瘤治療的鼻咽癌患者。
研究共入組了289例患者,按1:1的比例分到兩組,其中146例接受免疫治療(特瑞普利單抗)聯合目前的標準化療——吉西他濱+順鉑(即GP方案)(下文簡稱:特瑞普利單抗組),143例接受GP方案化療及安慰劑(下文簡稱:安慰劑組)。
JUPITER-02研究也是目前全球範圍內規模最大的「免疫+化療」一線治療晚期鼻咽癌患者的III期臨床研究。
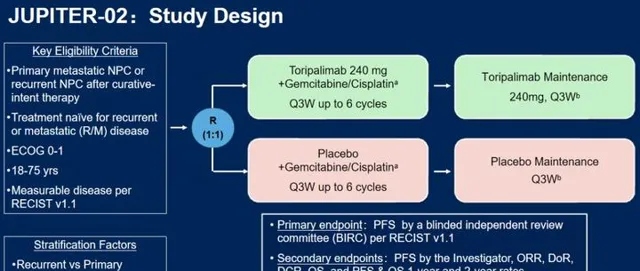
在最多六個周期的聯合治療後,兩組分別繼續使用特瑞普利單抗或安慰劑進行維持治療。研究中用來評價療效的主要終點是設盲的獨立評審委員會(BIRC)評估的無進展生存期(PFS),也就是自隨機開始,通俗講為患者從開始治療,到出現疾病進展的時間,次要終點有研究者評估的PFS、ORR、DoR、OS等等。
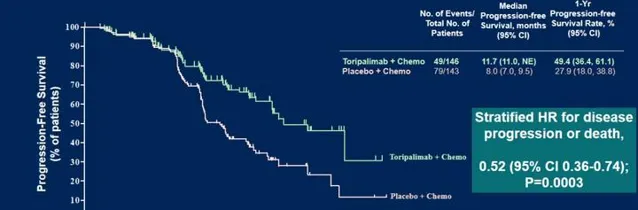
下面這張圖就能直觀體現出來,在標準化療基礎上加用特瑞普利單抗,能顯著改善患者的無進展生存PFS:安慰劑組的中位PFS是8個月,而特瑞普利單抗組是11.7個月,
延長了3.7個月
;加用特瑞普利單抗將患者出現疾病進展的風險大幅降低,
降低了48%
;治療開始12個月後,特瑞普利單抗組仍有
49.4%的患者病情沒有進展
,而安慰劑組僅為27.9%,特瑞普利單抗組1年的PFS率接近安慰劑組的2倍,而且從研究的亞組分析來看,各個亞組的患者均能從特瑞普利單抗組中獲益,尤其是
不論患者的PD-L1表達水平如何
,均可獲益。
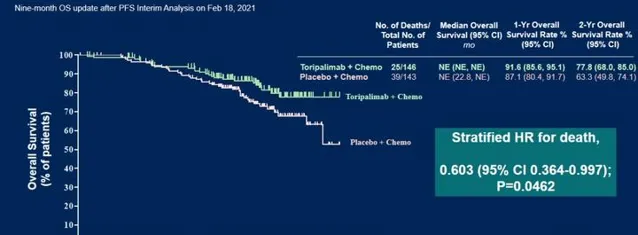
而截至2021年2月的生存期數據分析中,雖然特瑞普利單抗組和安慰劑組的中位OS都還沒有達到,但特瑞普利單抗組的1年總生存率是91.6%、2年總生存率是77.8%,而安慰劑組分別是87.1%和63.3%。
從現有的初步數據來看,
在標準化療基礎上加用特瑞普利單抗治療,能使患者的死亡風險下降40%!
從下圖中可以看到,兩組的生存曲線隨著時間推移逐漸拉開,並且
特瑞普利單抗組的OS曲線在2年左右進入了相對穩定的平台期,呈現長拖尾狀態,體現了免疫治療的長效性
;而安慰劑組OS曲線在2年後呈現快速降低的趨勢。
在ORR、DoR兩項療效指標上,特瑞普利單抗組也都明顯優於安慰劑組:兩組的ORR分別為
77.4% vs. 66.4%
,特瑞普利單抗組有效率顯著提高,增加了10%(p=0.0335);而兩組的中位DoR分別是
10.0 vs. 5.7個月
(p=0.0014),說明特瑞普利單抗組的緩解持續時間也明顯延長,延長了將近一倍。
在全面改善療效指標的同時,加用特瑞普利單抗治療也沒有增加患者的安全性風險,兩組開始治療後出現的不良事件、與治療藥物有關的不良事件、≥3級不良事件、輸液反應及致死性不良事件的發生率都類似,說明特瑞普利單抗聯合化療安全性良好。
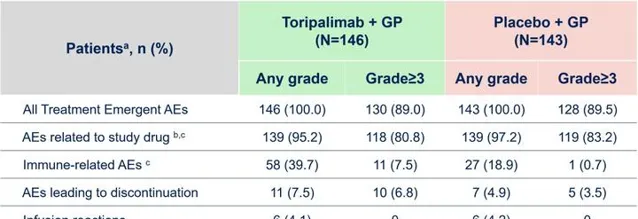
用一句話來總結JUPITER-02研究:特瑞普利單抗聯合標準化療,相比只套用標準化療,顯著改善了PFS、OS、ORR和DoR四大療效指標,而且沒有增加安全性風險。
徐瑞華教授
表示:「鼻咽癌治療充滿挑戰,因為它一般在相對晚期時才被確診,這類患者目前的治療選擇極其有限,而特瑞普利單抗治療為患者帶來了更長期的緩解,這是鼻咽癌治療領域的重大進步。」
國外專家也對JUPITER-02研究給予了高度評價,
ASCO首席醫學官兼執行副主席Julie R. Gralow博士
指出:「與其它癌癥相比,晚期鼻咽癌的治療進展比較落後,JUPITER-02研究的成果將改變鼻咽癌治療的模式,為患者帶去新的希望」。
三、鼻咽癌「全線通關」,國產PD-1抑制劑即將走上國際舞台
JUPITER-02研究的成功,意味著特瑞普利單抗在鼻咽癌治療中的「全線通關」:基於前面提到的POLARIS-02研究,
特瑞普利單抗已經在2021年2月獲得中國國家藥品監督管理局(NMPA)批準,用於既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療
,讓特瑞普利單抗成為全球首個獲批鼻咽癌適應證的免疫治療藥物。
特瑞普利單抗不僅「立足中國」,還在鼻咽癌的治療上快速走向國際:
JUPITER-02研究的成功,也成為特瑞普利單抗一線治療適應證上市申請的依據,目前這一申請已經獲得NMPA受理,相信特瑞普利單抗能夠讓國內外更多鼻咽癌患者受益於免疫治療。
而自2016年初開始臨床研發以來,特瑞普利單抗至今已在全球開展了30多項臨床研究,探索單藥或聯合治療在黑色素瘤、尿路上皮癌、肺癌、胃癌、食道癌、肝癌、膽管癌、乳癌、腎癌等癌癥中的療效和安全性。
積極挖掘臨床治療需求,為中國乃至全世界癌癥患者提供更合適的免疫治療,以特瑞普利單抗為代表的國產抗腫瘤創新藥,已經在承擔這樣的重任了。效果更好、價格更優的免疫治療選擇,對癌癥病友們來說當然是好事情,所以也希望「特瑞普利單抗們」能一直贏下去。
參考資料:
[1]. Xu Z J, Zheng R S, Zhang S W, et al. Nasopharyngeal carcinoma incidence andmortality in China in 2009[J]. Chinese Journal of Cancer, 2013, 32(8): 453.
[2]. Global Cancer Observatory. GLOBOCAN 2020.
[3]. Dou H, Hu D, Lam C, et al. Retrospective analysis ofresults of treatment for nasopharyngeal carcinoma in Macao[J]. Chinese Journalof Cancer Research, 2014, 26(2): 148.
[4]. Hong S, Huang Y, Yang Y, et al. GEM20110714: Final overallsurvival results of the phase III study of first-line gemcitabine pluscisplatin versus fluorouracil plus cisplatin in recurrent or metastaticnasopharyngeal carcinoma[J]. Journal of Clinical Oncology, 2020, 38(15_suppl):6521.
[5]. Larbcharoensub N, Mahaprom K, Jiarpinitnun C, et al.Characterization of PD-L1 and PD-1 expression and CD8+ tumor-infiltratinglymphocyte in Epstein-Barr virus-associated nasopharyngeal carcinoma[J]. American Journal of Clinical Oncology, 2018, 41(12):1204-1210.
[6]. Wang F H, Wei X L, Feng J, et al. Efficacy, safety, andcorrelative biomarkers of toripalimab in previously treated recurrent ormetastatic nasopharyngeal carcinoma: a phase II clinical trial (POLARIS-02)[J].Journal of Clinical Oncology, 2021, 39(7): 704-712.
[7]. Ren C, Wei X-L, Xu N, et al. Clinical response andbiomarker analysis of a phase II basket trial of toripalimab, a PD-1 mAb incombination with standard chemotherapy as a first-line treatment for patientswith solid tumors[J]. Journal of Clinical Oncology, 2020, 38(15_suppl): e15083.










