如果現在讓你想象一下細胞內部的結構,你的第一反應或許是高中生物教材給出的彩繪圖,不同顏色描繪著不同的胞器,例如線粒體、內質網和高基氏體。
但細胞內部的復雜結構遠遠超過了這些範例所描繪的景象,甚至我們未知的亞細胞結構可能比已知的還要多。【自然】上展示的一項新研究透過人工智能(AI)的幫助,讓我們見證了更多全新細胞結構的存在,並且得出了一個結論: 我們現在對細胞內部仍是一知半解。

當下,想要看清楚細胞內部的細節主要依靠兩種途徑: 熒光顯微成像和生物物理聯系 ,前者透過給蛋白帶上熒光標記物,然後在顯微鏡下觀察蛋白的位置和聯系。後者則包括親和純化和質譜技術,需要使用抗體將特定蛋白拉出細胞,最後分析蛋白上還結合著哪些分子。
兩種方式分別產生了包括大量細胞細節的數據庫——人類蛋白質圖譜(HPA)和BioPlex,但它們又有著各自的區別。顯微成像可以觀察到微米級別的水平結構,讓我們看到和胞器相關的蛋白標誌。生物物理聯系則可以找到蛋白與蛋白之間的相互作用和納米級的細節。

如何結合兩者的優勢,解決不同水平的差異來展現更多的細節呢?
【自然】的新研究給出的答案是使用AI,研究者設法將HPA和BioPlex的蛋白數據集合到一起,然後加入了深度神經網絡。在機器學習過程中, 它會將亞細胞分布或互作上相近的蛋白置於同一區塊中 。然後AI需要不斷重復學習,對蛋白與蛋白之間的距離進行計算分析,最後形成一張多水平整合細胞圖譜(multi-scale integrated cell 1.0,MuSIC 1.0)。
由於HPA和Bio Plex的數據部份都是基於人類腎細胞系HEK293獲得的,因此研究選擇了用這一細胞系的數據來測試AI的功能。他們一共獲取了661種蛋白數據,AI按照蛋白間距離從小到大的順序,首先找到具有強相似性的蛋白社群,隨後再找到蛋白間從強到弱的聯系,並以此對蛋白進行分區。 最終的MuSIC 1.0版本共在HEK293找到了69個蛋白社群。
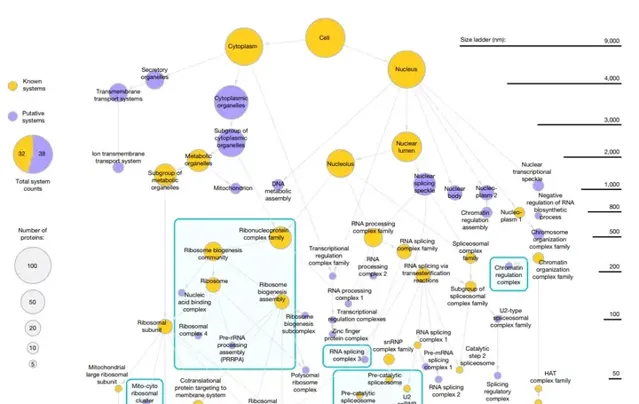
比如AI透過分析兩部份數據庫將一個催化前的剪接體放置在了48 nm蛋白社群中,此外AI還分析出這個蛋白下的兩個亞單位U1和U2分別為8 nm和33 nm。 研究透過冷凍電鏡確定了這一預測結果與實際相差不大。

除此之外,AI找到的這近70個蛋白社群中, 幾乎有一半是我們從未發現過的 ,比如有一組織蛋白能夠形成一種未發現過的結構。
許多疾病的根源都是細胞內部的功能混亂,無論是蛋白表達異常導致的腫瘤,還是線粒體異常導致的代謝性疾病,都有許多細節等待人們去發現,前提是我們能清楚地知道細胞內部有哪些蛋白和分子,這樣才不會錯過一些關鍵的線索。
MuSIC現在並沒有分析每個蛋白所處的具體位置,因為它們所處的位置可能是流動性的。「下一步我們需要在更多的人類細胞系中進行測試,」研究的通訊作者Trey Iderk教授表示,「最終我們或能透過比較正常和異常細胞找到許多疾病的根源。
參考資料:
[1] We might not know half of what’s in our cells, new AI technique reveals. Retrieved Nov 24th, 2021 from https://www.eurekalert.org/news-releases/935756
[2] Yue Qin, Edward L. Huttlin, et al. A multi-scale map of cell structure fusing protein images and interactions. Nature. DOI: 10.1038/s41586-021-04115-9
▎藥明康德內容團隊編輯
本文來自藥明康德內容團隊,歡迎轉發到朋友圈,謝絕轉載到其他平台。
免責聲明:藥明康德內容團隊專註介紹全球生物醫藥健康研究進展。本文僅作資訊交流之目的,文中觀點不代表藥明康德立場,亦不代表藥明康德支持或反對文中觀點。本文也不是治療方案推薦。如需獲得治療方案指導,請前往正規醫院就診。
⤵️喜歡我們的內容,歡迎關註@藥明康德!或者點贊、評論、分享給其他讀者吧!











