原創 楠煙不可言 圖靈基因 2022-01-01 07:03
收錄於話題#前沿生物大數據分析
撰文:楠煙不可言
Nature新子刊
推薦度:⭐⭐⭐⭐⭐
亮點:
本研究全面辨識和註釋編碼細胞表面蛋白(SPs)的泛癌基因(GESPs),並描述了GESP表達模式、復發性基因組改變、重要性、受體-配體相互作用和治療潛力。同時研究還發現GESP的mRNA表達具有癌癥類別特異性,並且與蛋白質表達呈正相關,某些GESP亞群作為腫瘤細胞生長的常見或特異性必需基因發揮作用。此外研究人員還預測了受體-配體相互作用在癌癥中的實質性解除調控,並使用系統生物學方法,確定了具有治療潛力的癌癥特異性GESP。
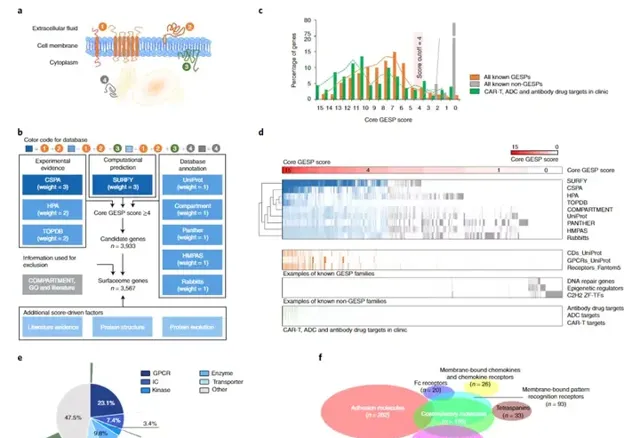
近日由賓夕法尼亞大學Lin Zhang研究組在
【Nature Cancer】
雜誌上發表了一篇名為
「
The Cancer Surfaceome Atlas integrates genomic, functional and drug response data to identify actionable targets
」
的文章。細胞表面蛋白(SPs)是免疫和靶向治療的豐富來源。透過系統地整合單細胞和體細胞基因組學、功能研究和靶點可操作性,本研究結合了多種計算方法,系統地表征了 33 種成人癌癥的人類表面組。開發了一個可公開存取的表面組數據庫 (TCSA),以幫助研究人員探索癌癥基因組中的 GESP。

細胞表面蛋白(SPs)是跨越或錨定/嵌入細胞表面質膜的蛋白質,控制細胞與細胞外環境之間的通訊。SPs在細胞膜上發揮特定的功能,如營養和離子運輸、細胞間相互作用、受體介導的訊息傳遞、酶反應和免疫辨識。由於其關鍵的生物學功能和獨特的亞細胞定位,SPs被認為是辨識免疫和靶向治療靶點的關鍵結構。事實上,60%以上SPs已經成為經批準的人類疾病藥物的靶標。此外,SPs(尤其是在體液中)已被用作早期檢測、診斷和預測疾病的分析的資訊生物標記物。透過抗體或嵌合抗原受體T細胞(CAR T)靶向在腫瘤細胞膜上高度或特異性表達的SP已成為癌癥患者的一種強有力的治療策略。本研究的總體目標是系統地描述癌癥的表面組,並為研究開發一個全面的表面組數據庫。
在全基因組範圍內定義人類表面蛋白組。實驗和計算方法已被套用於辨識和預測位於細胞表面膜上的蛋白質,盡管每種策略都有其自身的局限性,導致不完整覆蓋率和誤報。為了克服這個問題並全面定義基因組中的人類表面蛋白組,研究人員整合了來自九個獨立資源的
GESP,其中透過不同的策略辨識或預測了
SP。隨後研究收集了靶向腫瘤細胞
SPs
的
CAR-Ts、ADCs(抗體藥物偶聯物)和抗體藥物的靶點(FDA
批準或臨床開發中),發現其中
97.0%
具有核心
GESP得分≥4。接下來,研究人員透過來自
COMPARTMENT、基因本體論
(GO)
和手動文獻搜尋的資訊用於去除細胞內膜(如核膜和線粒體膜)中編碼蛋白質的基因。最後,其他特征,如文獻證據、蛋白質結構和前進演化保守性,被用作額外的分數驅動因素,以最終確定
GESP
列表並估計最終的
GESP
分數(圖1)。
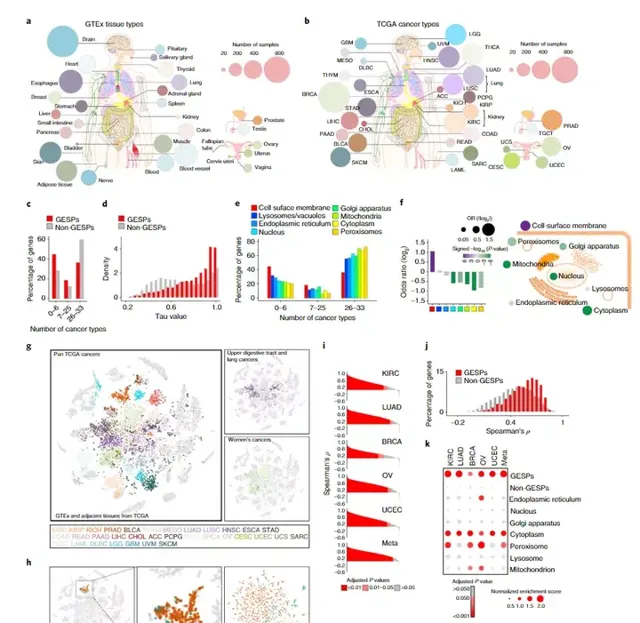
GESP在正常和腫瘤標本中的表達。為了表征GESP的信使RNA表達,分析了GTEx和癌癥基因組圖譜(TCGA)專案的RNA測序(RNA seq)圖譜。結果發現只有22.1%的GESP在所有癌癥類別中普遍表達;相比之下,48.4%的非GESP(16723中的8100個)是可檢測的。對於每個基因,研究分析了其mRNA可檢測到的癌癥類別的數量,發現確實與非GESP相比,GESP在癌癥類別中的表達明顯減少。組織特異性index36分析一致表明,與非GESP相比,大部份GESP表現出癌癥類別特異性。這些結果透過對按蛋白質亞細胞位置分類的每個基因亞組的富集分析得到進一步證實。一致地,基因集富集分析(GSEA)表明,正相關基因在GESP以及位於細胞質中的一組基因中顯著富集。這一結果表明,GESP的mRNA表達可用於預測癌癥中的蛋白質表達(圖2)。
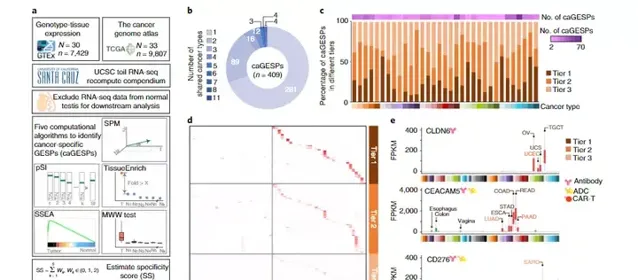
為了系統地辨識癌癥特異性GESP(CAGESP),研究使用了五種不同的計算策略,透過比較特定癌癥類別(TCGA)和所有正常組織(GTEx)中GESP的表達水平,估計每個GESP的表達特異性得分。鑒於癌睪丸基因通常編碼癌免疫治療的免疫原性抗原,正常睪丸組織的RNA-seq圖譜被排除在正常組織之外(睪丸生殖細胞腫瘤(TGCT)分析除外)。為了減少腫瘤標本中腫瘤浸潤性免疫細胞的表達幹擾,排除免疫細胞中高表達的GESP(造血系統惡性腫瘤分析除外),基於來自30種不同類別造血細胞和6種淋巴組織的RNA-seq圖譜。總共鑒定了409個獨特的CAGESP,它們在至少1種癌癥類別中特異表達。盡管大多數CAGESP被確定為單一癌癥類別,但我們發現26.4%(128/409)的CAGESP被一種以上的癌癥類別所共享,這表明這些CAGESP可能在腫瘤發生過程中受共同致癌訊號的調節。在系統回顧每個caGESP後,我們發現,在大多數情況下,使用單個caGESP「唯一」定義腫瘤和「完全」保留正常細胞仍然是一個挑戰(圖3)。
例如,在CAR-T和ADC治療開發中廣泛使用的caGESP靶點MSLN(間皮素)的低水平表達也在肺、輸卵管和唾液腺組織中檢測到,盡管間皮瘤、胰臟癌(PAAD)的腫瘤標本,卵巢漿液性囊腺癌和肺腺癌的表達水平特別高。這可能導致免疫治療潛在的「靶向-非腫瘤」毒性副作用。為了克服這個問題,多個CAGESP的組合被認為是一種更精確和適應力更強的腫瘤辨識策略。例如,CAR-T可設計為「布爾a和B」SP辨識邏輯門,該邏輯門僅在兩種蛋白質(a和B)均在腫瘤細胞中表達時啟用。在這方面,研究人員開發了一種計算方法,用於確定邏輯門控CAR-T設計的caGESP組合並確定其優先級。研究人員隨後定義了GESP對,其中caGESP及其配對的GESP在相同的正常組織中共表達,並且在caGESP被確定的癌癥類別中,配對的GESP未被檢測到,作為「iCAR-T」策略的潛在候選者。在21種癌癥類別中平均發現25對,共鑒定出443對獨特的配對(圖4)。

接下來研究人員確定了GESP復發性基因組改變的特征。GESP的SCNAs具有腫瘤類別特異性:989例復發SCNAs的GESP中有497例(50.2%)僅在單一腫瘤類別中發現,在>11種腫瘤類別中未觀察到GESP復發CNA。研究人員還估計了泛癌總體G評分,並行現19.8%(200/989;113例擴增,81例缺失)的總體G評分高於臨界值。研究最初確定143個GESP在至少1種腫瘤類別中具有復發性突變,研究還估計了泛癌總體M評分,發現37.8%(54/143)的GESP總體M評分高於使用肘部法確定的臨界值。CTNNB1、EGFR(表皮生長因子受體)、GNAQ和FAT 1(脂肪非典型鈣粘蛋白1)在所有腫瘤類別中的總體M評分最高(圖5)。
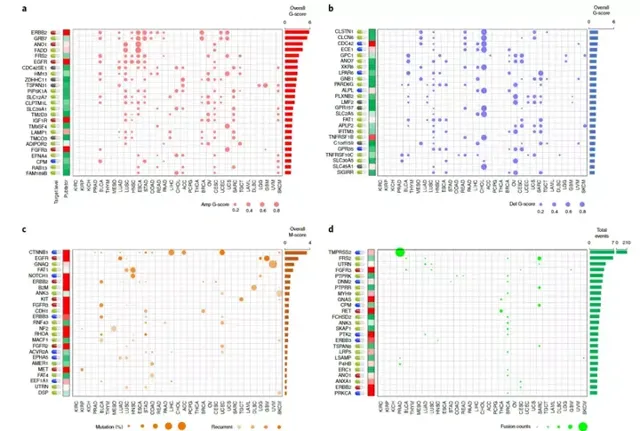
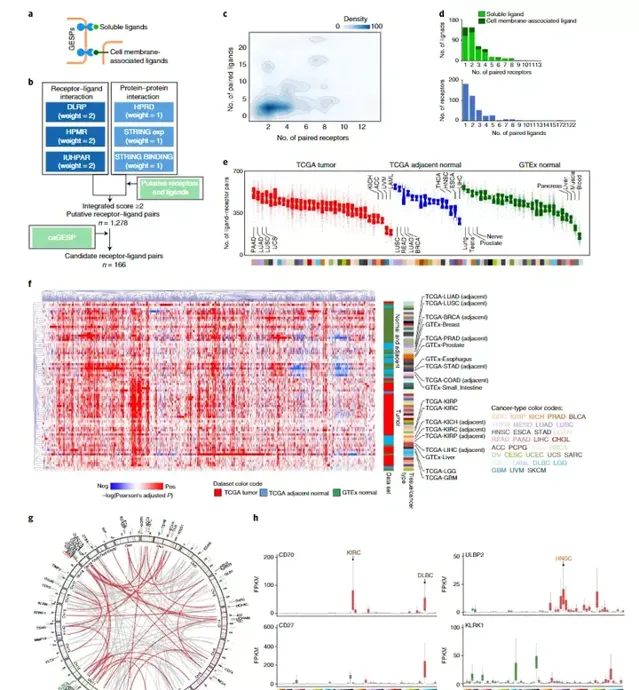
研究人員確定了GESP受體-配體相互作用的表征。先前分析排除了大部份GESP作為細胞表面受體,直接與可溶性或細胞膜相關受體(如核受體)相互作用。其中,1個受體平均與2.8個配體結合(範圍:1-22),而1個配體平均與2.7個受體相互作用。RNA-seq可檢測到受體和配體的配對數量在組織和腫瘤類別中差異很大。接下來,研究使用Pearson試驗分析了特定組織或癌癥類別中每個已辨識受體-配體對的表達相關性,並行現至少一個GTEx和TCGA組織中99.1%(1267/1278)和99.2%(1268/1278)的受體-配體對的表達分別顯著正相關。重要的是,對受體-配體對相關性的無監督聚類分析表明,正常(GTEx)和腫瘤鄰近(TCGA)組織聚集在一起,並且在很大程度上與腫瘤組織分離。明腫瘤發生過程中受體-配體相互作用網絡明顯失調。正如預期的那樣,來自同一譜系的正常組織和腫瘤相鄰組織聚集在一起;在癌癥中也觀察到類似的模式(圖6)。
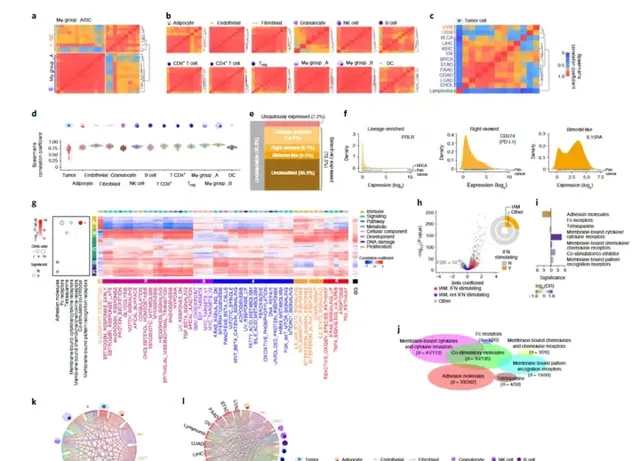
MIMS是從人類基因組中鑒定的GESP的主要功能組之一,透過調節免疫反應在腫瘤發生中發揮關鍵作用。了進一步描述它們在腫瘤微環境中的表達,研究比較了mIAMs在腫瘤中每個細胞群中的表達相似性。來自13種癌癥類別。mIAM在不同基質細胞群中的表達差異很大,甚至在差異相關的細胞類別之間(例如,巨噬細胞和樹狀細胞(DC)))。然而,從不同癌癥類別分離的基質細胞類別群體的MIM表達特征相似,表明它們在不同癌癥類別的相同基質細胞群體中的表達相對一致。相反,不同癌癥類別的腫瘤細胞中的MIM表達模式高度異質,反映了癌癥譜系:上皮性腫瘤聚集在一起,並與神經和血液系統惡性腫瘤分離(圖7c)。mIAMs在腫瘤細胞中的異質性表達可能導致不同癌癥之間腫瘤免疫相互作用的內在差異,因為mIAMs在基質細胞中的表達相對均勻。有趣的是,在腫瘤細胞和非免疫基質細胞群(如成纖維細胞和內皮細胞)之間也發現了大量MIM介導的相互作用,這表明它們也可能參與腫瘤微環境中的免疫調節(圖7)。
總而言之,本研究全面辨識和註釋編碼細胞表面蛋白(SPs)的泛癌基因(GESPs),由於其獨特的蛋白質亞細胞位置和重要的生物學功能,GESP被認為是鑒定人類疾病藥物靶點的主要來源。研究鑒定了409種在某些癌癥類別(caG-ESP)中「特異性」表達的獨特GESP,為免疫治療的潛在GESP靶點提供了全基因組視角。鑒於「靶向-非腫瘤」毒性副作用是CAR-T和抗體療法的主要臨床問題之一,因此能夠更特異地辨識癌細胞的策略對於開發有效和安全的免疫療法至關重要。因此,使用多種GESP組合的技術,如邏輯門控CART和雙特異性抗體,可以進一步提高藥物特異性,從而為癌癥患者創造更精確的治療。
教授介紹

Lin Zhang,賓夕法尼亞大學醫學院教授,研究工作集中在分子機制的表征和透過結合計算和分子生物學方法開發癌癥的新療法。他的團隊報道了長非編碼 RNA 在癌癥中表現出高頻率的基因組改變,開發了針對 DNA 修復途徑的新策略,結合抑制某些長鏈非編碼 RNA 或表觀遺傳調節因子來治療乳癌和卵巢癌。
參考文獻
1、Zhongyi Hu, Jiao Yuan, Meixiao Long et al. The Cancer Surfaceome Atlasintegrates genomic, functional and drug response data to identify actionabletargets (2021). https://www.
nature.com/articles/s43
018-021-00282-w











