尝试过减肥的人都知道,减重本身已经很艰难,而维持减重后的体重更是难上加难。
很多人在减肥后不久就会遇到体重反弹的问题,这不仅仅是行为和饮食习惯难以持久改变所致,很多时候,身体本身的机制也在起作用。
最近,【自然】杂志发表了一篇来自苏黎世联邦理工学院科研团队的研究论文,揭示了肥胖对身体的深远影响。研究团队分析了成功减重者的脂肪组织,发现曾经的肥胖状态导致的细胞转录变化在减重两年后依然存在。

研究人员在小鼠实验中也发现了类似现象:「胖过」的脂肪细胞更倾向于吸收更多的糖和脂肪,一旦再次接触到高脂食物,小鼠的体重会更快地恢复到之前的水平。
这项研究使用了来自MTSS、LTSS和NEFA三项减肥手术相关的临床研究中的脂肪组织样本,包括手术前(T0)和手术后两年(T1)的皮下脂肪(scAT)和网膜脂肪(omAT)。所有参与者的BMI至少降低了25%,健康体重者的数据作为对照组。
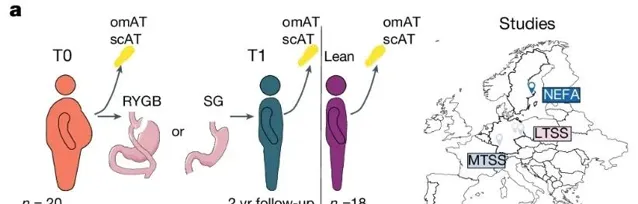
通过单细胞核RNA测序(snRNA-seq)分析发现,网膜脂肪(omAT)样本中存在18个细胞簇,尽管细胞组成在T0和T1之间没有显著差异,但许多在T0时的差异表达基因(DEG)在T1时仍然失调。皮下脂肪(scAT)中也观察到了类似的结果,表明肥胖引起的脂肪组织细胞转录变化在减重后仍未恢复。
进一步的研究发现,肥胖期间的转录失调在脂肪细胞、脂肪细胞祖细胞(APC)和内皮细胞中最为明显。功能上,与脂肪细胞代谢和功能相关的通路下调,而与纤维化和细胞凋亡相关的通路上调。
为了验证这一发现,研究者在小鼠中进行了实验。首先,小鼠被喂食高脂饮食(HFD)一段时间以使其变胖,然后改为低脂饮食,让它们在4-8周内减重至正常体重。结果显示,大多数肥胖导致的代谢指标在减重后恢复到正常水平,但附睾脂肪(epiAT)中的细胞变化却不容乐观。
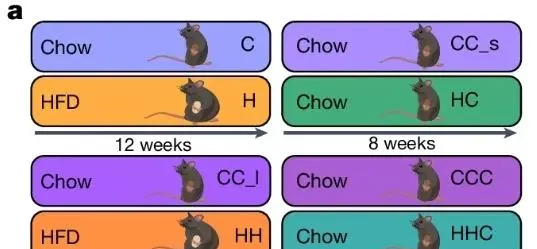
肥胖时,小鼠epiAT中的巨噬细胞数量显著增加,减重后也没有减少,尤其是脂质相关巨噬细胞(LAM)和非血管周围巨噬细胞的数量增加,导致巨噬细胞群结构发生变化。与人类组织的测序结果一致,小鼠epiAT中肥胖导致的DEG在减重后仍然存在,包括溶酶体活性、细胞凋亡和其他炎症途径相关基因的上调,以及脂肪代谢相关基因的下调。
有趣的是,研究者发现,喂食HFD时间更长的小鼠在减重后,没有任何DEG恢复正常表达,情况比喂食HFD时间较短的小鼠更严重。这表明,长时间的肥胖或较短的减重时间会强化「胖记忆」。
研究者进一步分析了「胖记忆」的成因,发现主要是表观遗传机制在起作用。减重后,57-62%的下调DEG和68-75%的上调DEG都可以用表观遗传解释。

「胖记忆」会导致什么样的后果呢?研究者发现,胖过的小鼠的附睾脂肪(epiAT)对葡萄糖和棕榈酸酯的摄取显著增加。再次喂食高脂饮食时,这些小鼠的体重恢复速度比从未胖过的小鼠更快。
目前,研究者还不能确定这种肥胖记忆能够持续多久,或许有一个时间窗口,或许会一直持续。无论如何,这一发现为我们理解肥胖和体重管理提供了新的视角,也为未来的治疗策略提供了新的思路。











