新生兒呼吸窘迫症候群
(Neonatal Respiratory Distress Syndrome)
呼吸疾病學名詞
概述部份
新生兒呼吸窘迫症候群,又稱新生兒肺透明膜病。指新生兒出生後不久即出現進行性呼吸困難和呼吸衰竭等癥狀,主要是由於缺乏肺泡表面活性物質所引起,導致肺泡進行性萎陷,患兒於生後4~12小時內出現進行性呼吸困難、呻吟、發紺、吸氣三凹征,嚴重者發生呼吸衰竭。發病率與胎齡有關,胎齡越小,發病率越高,體重越輕病死率越高。
新生兒呼吸窘迫症候群是早產兒死亡的主要原因之一。隨著胎齡的增加,其發生率也隨之降低。
● 中文別名: 新生兒肺透明膜病
● 英文別名: Respiratory distress syndrome, RDS;Hyaline membrane disease, HMD
目錄
1. 定義
2. 病因及發病率
3. 臨床表現
4. 檢查與診斷
5. 預防與治療
6. 參考文獻
1
定義
新生兒呼吸窘迫症候群(Neonatal Respiratory Distress Syndrome, NRDS)為肺表面活性物質(Pulmonary Surfactant, PS)缺乏所致的兩肺廣泛肺泡萎陷損傷滲出的急性呼吸衰竭,多見於早產兒和剖宮產新生兒,生後數小時出現進行性呼吸困難、青紫和呼吸衰竭。病理上出現肺透明膜,又稱肺透明膜病(Hyaline Membrane Disease,HMD) [1]。
2
病因及發病率[1]
2.1 病因
由於PS缺乏所致,PS由肺泡2型上皮細胞合成分泌,分布於肺泡液面形成單分子層,能降低肺泡表面張力,防止肺泡萎陷和肺水腫(圖1)。
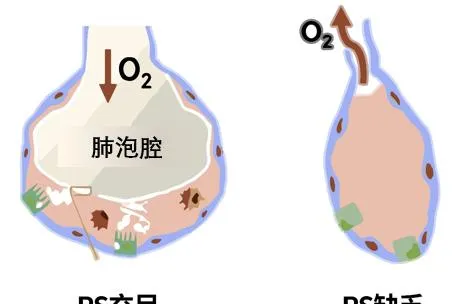
圖1 PS充足和PS缺乏時的肺泡對比
導致肺表面活性物質缺乏的因素包括:
1) 早產兒:由於發育未成熟肺泡2型上皮細胞合成PS不足所致。
2) 剖宮產新生兒:沒有經過釋放大量兒茶酚胺和糖皮質激素的正常分娩,導致PS分娩和釋放不足。
3) 糖尿病母親新生兒:母親糖尿病時,胎兒可抑制糖皮質激素的胰島素分泌相應增加,PS合成分泌受影響。
4) 圍產期窒息:缺氧、酸中毒、低灌註可導致急性肺損傷,抑制肺泡2型上皮細胞產生PS。
5) PS蛋白功能缺陷: PS蛋白中的SP-A、SP-B、SP-C的基因突變或某些缺陷不能表達蛋白,導致PS功能缺陷。
6) 重度Rh溶血病:Rh溶血病患兒胰島細胞代償性增生,胰島素分泌過多抑制PS分泌。
2.2 發病機制
PS的主要功能是降低肺泡表面張力,保持肺泡擴張。PS缺乏使肺泡表面張力增高,肺泡逐漸萎陷,發生進行性肺不張,影響通氣換氣功能,導致缺氧和酸中毒等。缺氧和酸中毒導致肺小動脈痙攣,肺動脈高壓,動脈導管和卵圓孔開放,右向左分流。結果使缺氧加重,肺毛細血管通透性增高,血漿纖維蛋白滲出形成肺透明膜,覆蓋肺泡表面,使缺氧酸中毒更加嚴重,造成惡性迴圈(圖2)。

圖2 PS缺乏所致惡性迴圈
2.3 疾病發病率
早產兒RDS發生率約5%~10%,胎齡越小發病率越高,擇期剖宮產NRDS發生率0.9%~3.7%。
3
臨床表現[1]
3.1 早產兒RDS
生後1-2小時內出現呼吸急促(RR>60次/分),進而接入出現呼吸困難,呻吟,吸氣時三凹征,青紫,病情呈進行性加重,至出生後 6小時癥狀已非常明顯。然後出現呼吸不規則,呼吸暫停,呼吸衰竭。出生24-48小時病情最為嚴重。
3.2 剖宮產新生兒RDS
主要見於晚期早產兒和足月兒,與剖宮產的胎齡密切相關,胎齡< 39 周剖宮產發生率較高。剖宮產NRDS 起病時間差異大,有些患兒在出生後1-2 小時就發生嚴重呼吸困難,有些患兒出生後第1天呼吸困難並不嚴重,胸片顯示為濕肺表現,但在生後第2天或第3天呼吸困難突然加重,胸片兩肺呈白肺,發生呼吸衰竭。
3.3 PS蛋白缺陷RDS
出生後數小時即發生嚴重呼吸困難,進行性加重,表現為重癥呼吸衰竭,給PS治療後短時間內(2-3 小時)臨床表現改善,但5-6小時後臨床表現又非常嚴重,依賴PS 的治療,最後預後較差,多於數天內死亡。
4
檢查與診斷
4.1 輔助檢查[2]
選擇合適的檢查工具、掌握和辨識NRDS的早期征象和積極幹預,可明顯改善預後及降低新生兒死亡率。目前常用的檢查包括X線檢查、肺部超聲、胎兒肺成熟度等。
1) X線檢查: NRDS患兒主要胸部X線征象包括:「網狀顆粒」或「毛玻璃」征、支氣管充氣征、「白肺」(圖3)。
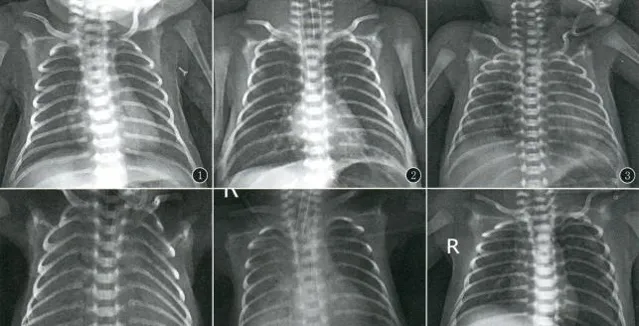
圖3[3] ①Ⅰ級,肺內可見廣泛細小顆粒影,以兩下肺為主②Ⅱ級,兩肺呈磨玻璃樣改變,可見支氣管充氣征 ③Ⅲ級,兩肺廣泛分布的支氣管充氣征,心緣和膈面模糊 ④Ⅳ級,A:肺呈「白肺」狀,心緣及膈面不可辨,可見支氣管充氣征;B:並行肺出血,兩肺大片高密度影,以右下肺為著,氣管插管血性液體湧出 ⑤左側氣胸,肺內仍可見廣泛細小顆粒影及支氣管充氣征
2) 床旁肺部超聲:肺超聲無放射性,對NRDS的診斷具有較高的靈敏性和特異性。NRDS肺部超聲征象及診斷依據包括肺實質性病變伴有支氣管充氣征、胸膜線異常與A-線消失、肺的非實質性病變可以呈現融合B-線或肺間質症候群樣改變、雙肺點、胸腔積液等。
3) 胎兒肺成熟度(fetal lung maturity,FLM):NRDS患兒生後能否存活,主要取決於PS的分泌情況及胎兒肺成熟度。目前臨床上評估胎兒肺成熟度主要是依靠羊膜腔穿刺抽羊水進行分析, 包括測定羊水卵磷脂/鞘磷脂比值(L/S)、檢測磷脂酰甘油(PG)、泡沫試驗和分光光度計測量650 nm時的光密度值(OD650)等。其中L/S和 PG測定是判斷FLM的「金標準」。
4.2 診斷及依據[1]
1) 病史:NRDS主要見於胎齡較小的早產兒,胎齡越小發生率越高;剖宮產新生兒RDS主要見於胎齡<39周足月兒或晚期早產兒;繼發性RDS有嚴重缺氧或感染等病史,常見於足月兒,早產兒也可發病。
2) 臨床表現:生後出現進行性呼吸困難嚴重低氧性呼吸衰竭。
3) 肺X線變化:NRDS按病情程度可將胸片改變分為4級。
•1級:兩肺野透亮度普遍性降低,毛玻璃樣(充氣減少),可見均勻散在的細小顆粒和網狀陰影。
•2級:兩肺透亮度進一步降低,可見支氣管充氣征,延伸至肺野中外帶。
•3級:病變加重,肺野透亮度更加降低,心緣、膈緣模糊。
•4級:整個肺野呈「白肺」,支氣管充氣征更加明顯,似禿葉樹枝。
4.3 鑒別診斷[1]
1) B族溶血性鏈球菌感染:產前感染發生的B族鏈球菌(GBS)肺炎或敗血癥,臨床表現和肺部早期X線表現極似RDS,有時不容易鑒別。但該病常有孕婦羊膜早破史或感染表現,肺部X線改變有不同程度的融合趨勢,病程經過與RDS不同,抗生素治療有效。
2) 濕肺:重癥濕肺與 RDS較難鑒別濕肺生後數小時出現呼吸困難,但病程短,病情相對較輕,X線表現以肺泡間質葉間胸膜積液為主。
3) 感染性肺炎:表現為呼吸困難呻吟,但不呈進行性發展X線表現兩肺滲出分布不均勻。
5
預防與治療
5.1 預防
新生兒呼吸窘迫症候群的防治——歐洲共識指南2022版4中針對產前管理的推薦意見如下:
1) 妊娠<28-30周有早產風險的孕婦均應轉移至具有RDS診治經驗的圍產中心(B1) 。
2) 單胎妊娠孕中期或先兆早產的孕婦出現短宮頸,可以經陰道給予黃體酮治療,盡可能地增加孕周,減少圍生期死亡和並行癥 (A1) 。
3) 先兆早產的孕婦,可進行宮頸長度測量和精確的生物標記物測定,以避免不必要的使用宮縮抑制劑和(或)產前使用激素(B2) 。
4) 妊娠34周記憶體在早產風險的孕婦至少在分娩前24h給予單療程產前激素治療(A1) 。
5) 妊娠<32周再次出現早產征象,且距第1個療程產前激素治療超過1~2周者,可重復給予1個療程激素治療(A2) 。
6) 妊娠<32周,緊急分娩前應給予MgSO4 (A1) 。
7) 對極早產孕婦應考慮短期使用保胎藥治療,以有時間完成1個療程產前激素治療和(或)將孕婦轉運至圍產中心(B1) 。
5.2 治療
早產兒出生後應密切觀察呼吸變化,一旦出現呼吸增快、呻吟,應先使用無創通氣,並根據胸片和臨床表現,考慮RDS,即可早期開始治療,如病情嚴重,應立即氣管插管,使用機械通氣。
1) 無創通氣[1]:無創通氣能使肺泡在呼氣末保持正壓,防止肺泡萎陷,並有助於萎陷的肺泡重新張開。及時使用無創呼吸支持可減少機械通氣的使用,降低BPD發生率。
2) 機械通氣:對嚴重RDS或無創呼吸支持效果不理想者,應采用機械通氣,但應盡量縮短機械通氣時間[1]。新生兒呼吸窘迫症候群的防治——歐洲共識指南2022版4中推薦:若使用機械通氣(MV),應使用目標潮氣量通氣或高頻振蕩通氣(A1)。
3) 肺表面活性物質(PS)藥物治療[1]:PS治療可提高生存率並減少肺氣腫,因此在RDS的管理中發揮著重要作用。
•PS的主要成分是磷脂,約占90%;其次為肺表面活性物質蛋白(SP),占5%-10%;其余為中性脂肪和糖。磷脂主要為二棕櫚酰磷脂酰膽堿(DPPC),其它有磷脂酰甘油(PG)、磷脂酰乙醇胺(PE)和磷脂酰肌醇(PI)等。SP有4種,即SP-A、SP-B、SP-C和SP-D。磷脂必須與SP-B、SP-C相結合才能發揮最佳作用[1]。
•肺表面活性物質替代治療是早產兒呼吸治療進展的重要裏程碑。目前PS藥物已成為RDS的常規治療,國際上已有10多種PS藥品,國內有兩種PS藥品可供選用[1]。2001年,豬肺表面活性物質正式進入中國市場[5],2005年第一個國產牛肺表面活性物質問世。兩種不同動物來源的PS比較發現:
➣豬肺提取PS無論從胺基酸序列還是成分都與人類PS 更相近[6-8]。
➣每毫升豬肺PS比牛肺PS含有更多的磷脂、SP-B[9]。其中PC、DPPC、PE和PI的含量分別是牛肺PS的3倍、2倍、10倍和3倍[10]。
•對於PS的治療劑量,既往研究表明:較牛肺PS,豬肺PS 200mg/kg 治療可降低支氣管肺發育不良(Bronchopulmonary dysplasia,BPD)/死亡復合結局風險,減少重復給藥[9];也可顯著降低明顯血流動力學改變的動脈導管未閉(PDA)以及氣漏的發生率[11]。
•對於表面活性物質的使用時機,【中國新生兒肺表面活性物質臨床套用專家共識(2021版)】中推薦[12]:對早產兒RDS應強調早期給藥,建議早期使用nCPAP,如nCPAP壓力≥6 cmpO, FiO2>0.30,建議給予PS治療。對病情進展快,需要機械通氣的嚴重RDS,應立即給予PS治療。一項Cochrane綜述中指出,生後因RDS需機械通氣的患兒早期(出生2小時內)選擇性使用PS可以減少急性肺損傷,減少新生兒期死亡和慢性肺部疾病的發生[13]。
4) 體外膜肺[1]:對少數嚴重病例上述治療無效時,可使用ECMO技術作為嚴重呼吸衰竭的最後治療手段。
5) 支持治療[1]:RDS因缺氧高碳酸血癥導致酸堿、水電解質、迴圈功能失衡,應予及時糾正,使患兒度過疾病嚴重期。
6) 並行癥治療[1]:並行PDA出現癥狀使用藥物關閉。若藥物不能關閉動脈導管,並嚴重影響心肺功能時,應行手術結紮。
7) 原發病治療[1]:對繼發於重癥感染者,應積極抗感染治療。
6
參考文獻
1. 邵肖梅等, 實用新生兒學(第五版)[M], 北京, 人民衛生出版社, 2019.06.
2. 王會霞,陳彥香.新生兒呼吸窘迫症候群相關檢查套用進展[J].影像研究與醫學套用,2023,7(03):11-13.
3. 張靜,張翼,代勤,等. 新生兒肺透明膜病的X線征象和臨床分析[J]. 實用放射學雜誌,2015,31(12):2010-2012,2065.
4. Sweet DG, Carnielli VP, Greisen G, Hallman M, Klebermass-Schrehof K, Ozek E, Te Pas A, Plavka R, Roehr CC, Saugstad OD, Simeoni U, Speer CP, Vento M, Visser GHA, Halliday HL. European Consensus Guidelines on the Management of Respiratory Distress Syndrome: 2022 Update. Neonatology. 2023;120(1):3-23.
5.杜立中.早產兒呼吸支持藥物套用的幾個裏程碑[J].中國實用兒科誌,2018,33(05):321-323.DOI:10.19538/j.ek2018050601.
6. 魯帥堯,龍海亭,禹文海,和占龍,趙遠,楊鳳梅,李鴻鈞.人類與部份實驗動物RETN基因同源性分析[J].中國實驗動物學報,2012,20(05):69-73.
7. Bernhard W, Mottaghian J, Gebert A, Rau GA, von Der HARDT H, Poets CF. Commercial versus native surfactants. Surface activity, molecular components, and the effect of calcium. Am J Respir Crit Care Med. 2000 Oct;162(4 Pt 1):1524-33.
8. Poets CF, Arning A, Bernhard W, Acevedo C, von der Hardt H. Active surfactant in pharyngeal aspirates of term neonates: lipid biochemistry and surface tension function. Eur J Clin Invest. 1997 Apr;27(4):293-8.
9. Tridente A, De Martino L, De Luca D. Porcine vs bovine surfactant therapy for preterm neonates with RDS: systematic review with biological plausibility and pragmatic meta-analysis of respiratory outcomes. Respir Res. 2019 Feb 6;20(1):28.
10. Guo X, Luo S, Amidani D, Rivetti C, Pieraccini G, Pioselli B, Catinella S, Murgia X, Salomone F, Xu Y, Dong Y, Sun B. In vitro characterization and in vivo comparison of the pulmonary outcomes of Poractant alfa and Calsurf in ventilated preterm rabbits. PLoS One. 2020 Mar 13;15(3):e0230229.
11. Fujii AM, Patel SM, Allen R, Doros G, Guo CY, Testa S. Poractant alfa and beractant treatment of very premature infants with respiratory distress syndrome. J Perinatol. 2010 Oct;30(10):665-70.
12. 中華醫學會兒科學分會新生兒學組,中華兒科雜誌編輯委員會. 中國新生兒肺表面活性物質臨床套用專家共識(2021版)[J]. 中華兒科雜誌,2021,59(8):627-632.
13. Bahadue FL, Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev. 2012 Nov 14;11(11):CD001456.










