目前已在大約30%的人類癌癥中發現了RAS癌基因的突變。其中,KRAS的突變頻率遠高於HRAS和NRAS。 例如,大約12-15%的非小細胞肺癌患者攜帶KRASG12C突變,而攜帶KRAS突變的胰腺導管腺癌(PDAC)患者更是超過90%,尤其是KRASG12D和KRASG12V亞型。
然而,RAS抑制劑的開發一直困難重重,以至於RAS被認為是「不可成藥的靶點」。最近,直接靶向KRASG12C突變的小分子化合物被批準用於治療,但靶向其他KRAS突變在臨床上仍被認為是不切實際的。
近日,中山大學附屬第一醫院、南京大學等研究人員發現, 一種由基因間長鏈非編碼RNA(LINC00673)編碼產生的蛋白質RASON是致癌的RAS訊號通路的關鍵調控因子,有望成為KRAS突變癌癥的治療靶點 。這項成果於10月14日發表在【 Cell Research 】雜誌上。

研究材料與方法
在這項研究中,研究人員使用了多個胰臟癌細胞系,並透過CRISPR技術敲除了多個細胞系中的RASON基因。為了研究胰腺腫瘤生成,他們還使用了多個小鼠模型,
並委托賽業生物構建了Rason-/-小鼠
。他們透過免疫墨點和LC-MS分析來測定RASON的表達,並透過免疫沈澱、表面等離子共振和核磁共振等實驗來分析RASON與KRAS的交互作用。
研究結果
1.RASON蛋白與PDAC的預後不良相關
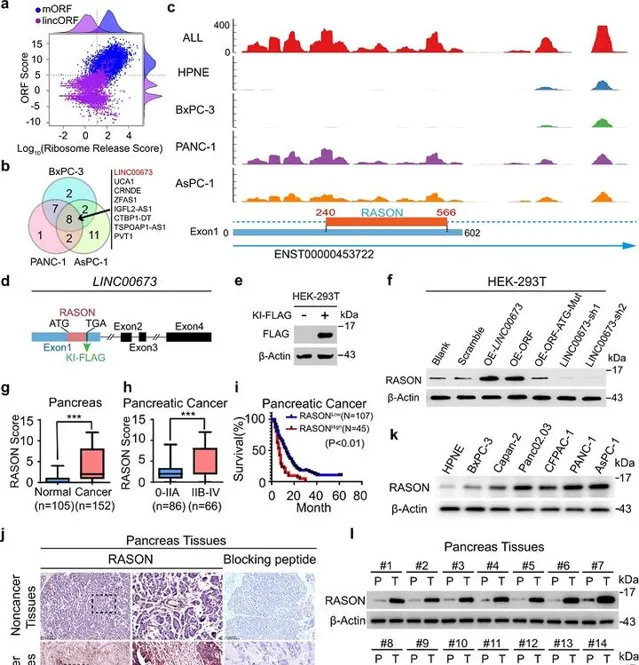
人類基因組中存在大量非編碼區,以往人們認為這些非編碼區是不編碼蛋白質的,但近年來的轉譯組研究卻從非編碼區中鑒定出數百種功能性肽段或蛋白質。於是,研究人員著手對胰臟癌樣本的非編碼區開展分析。
在比較三種PDAC細胞系與正常胰腺導管細胞系後,他們發現8個基因間長鏈非編碼RNA(lincRNA)存在差異轉譯,其中LINC00673位列第一。PDAC患者的腫瘤樣本與癌旁正常組織的比較也表明,LINC00673存在差異表達。他們透過免疫墨點分析證實LINC00673編碼了一種108個胺基酸的蛋白質,並命名為RASON。
在一個包含105個PDAC癌癥樣本和配對正常胰腺樣本的獨立佇列中,研究人員發現LINC00673在癌癥樣本中高表達,且其表達與腫瘤分級呈正相關。與此一致,RASON蛋白在癌組織中的表達也顯著升高,並且與腫瘤分級和總生存期較短呈正相關(圖1)。這些結果表明, RASON是一種癌蛋白,可作為PDAC的預後標誌物。
2.RASON對KRAS驅動的腫瘤發生至關重要
為了研究RASON在PDAC中的潛在功能,研究人員構建了兩個敲除RASON的胰臟癌細胞系。他們發現,RASON敲除後RAS下遊訊號通路被抑制,RASON過表達後則增強下遊通路
。
同時,活性KRAS-GTP水平也在RASON KO細胞中下調。此外,他們還生成了Rason同源物基因剔除
(Rason-/-)小鼠(該小鼠由賽業生物提供)
。Rason-/-小鼠的胚胎成纖維細胞和胰腺組織均表現出RAS訊號通路的顯著下調,
表明RASON參與了致癌KRAS訊號通路的調控
。
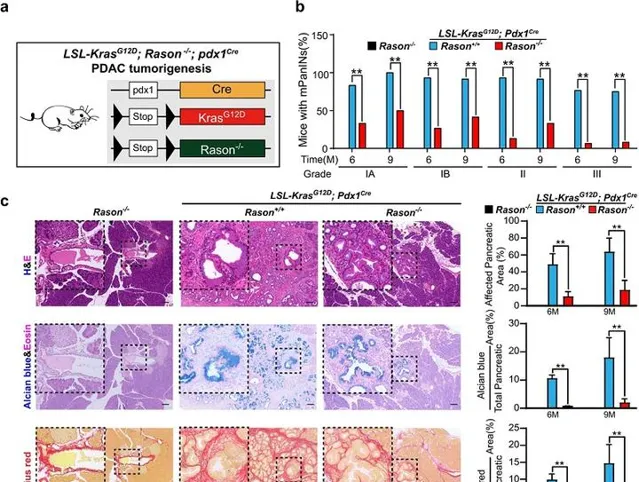
為了探索RASON是否參與了KRAS驅動的腫瘤發生,他們使用了穩定轉染KRASG12D或KRASG12V的RAS-less MEF細胞系,並測試了Rason KO對KRAS誘導的MEF細胞轉化的影響。他們生成了兩個Rason KO複制,發現Rason KO幾乎完全降低了KRASG12D或KRASG12V MEF細胞的成瘤潛能。裸鼠皮下成瘤實驗也證實了RASON在突變誘導的MEF細胞轉化中的關鍵作用。與對照細胞相比,Rason KO幾乎完全消除了腫瘤形成。
之後,研究人員將Rason-/-小鼠與KC小鼠(研究PDAC早期階段的成熟模型)雜交,生成了KCR小鼠。與KC小鼠相比,KCR小鼠在6個月和9個月大時的所有癌前病變形成均顯著減少,表明RASON參與了KRAS驅動的胰腺腫瘤形成的早期階段(圖2)。另一種經典的PDAC模型小鼠(KPC小鼠)上的研究也證實了這一點。這些數據表明, RASON是KRAS驅動的小鼠胰腺腫瘤發生所必需的 。
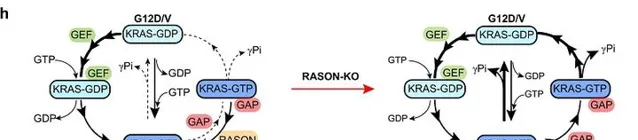
免疫沈澱分析表明,RASON與KRAS之間存在著直接交互作用。表面等離子共振分析(SPR)則顯示,RASON以非常高的親和力與KRASG12D和KRASG12V結合。核磁共振(NMR)滴定實驗的結果也強烈支持RASON與KRAS直接結合。後續的分析表明,RASON抑制GTP酶啟用蛋白(GAP)誘導的GTP水解,使KRAS始終保持在啟用狀態(圖3)。
3.RASON是PDAC的潛在治療靶點
由於KRAS突變的存在,大多數PDAC患者對EGFR抑制劑(西妥昔單抗)產生耐藥性。然而,西妥昔單抗和RASON shRNA的聯合治療最大限度地減少了裸鼠中的腫瘤生長,表明RASON抑制讓KRAS突變的癌細胞對西妥昔單抗敏感。這種聯合治療的效果在PDAC患者來源的類器官上也得到證實,
說明RASON是攜帶KRAS突變的PDAC患者的潛在治療靶點
。
研究結論
總的來說,研究人員發現了一種對KRAS訊號傳導至關重要的RASON蛋白。這種由lincRNA編碼的蛋白質直接與KRAS結合,讓KRAS穩定在與GTP結合的過度啟用狀態,因此是KRAS驅動的腫瘤發生和腫瘤維持所必需的。RASON的降低可增加胰臟癌對EGFR抑制劑的敏感性。
他們認為,對於人類癌癥中「不可成藥的」KRAS訊號通路,KRAS−RASON交互作用也許是一個可以攻擊的靶點
。
賽業小鼠疾病模型
賽業可提供上文中使用的疾病模型,現貨可直接訂購。
KC 小鼠模型
產品編號:
C001251
背景:
C57BL/6
基因型:
LSL-KrasG12D/+;Pdx1-Cre
簡介:
胰腺導管腺癌(PDAC)早期階段的成熟模型
KP 小鼠模型
產品編號:
C001320
背景:
C57BL/6
基因型:
LSL-KrasG12D/+;LSL-Trp53R172H
簡介:
胰腺導管腺癌(PDAC)的中間小鼠模型
KPC 小鼠模型
產品編號:
C001308
背景:
C57BL/6
基因型:
LSL-KrasG12D/+;LSL-Trp53R172H/+ ;Pdx1-Cre
簡介:
自發胰臟癌模型
動物模型客製服務
賽業生物致力於更好地服務客戶,為您構建更好的動物模型, 可提供多種個人化客製服務型別, 包括TurboKnockout基因編輯小鼠、CRISPR-Pro基因剔除/敲入大小鼠、基因改造大小鼠在內的多種動物模型。本試驗所使用的 Rason敲除(Rason-/-)小鼠,也均由賽業生物提供。
原文閱讀
點選「閱讀原文」 , 即可獲取文獻原文
原文檢索:
Cheng, R., Li, F., Zhang, M. et al. A novel protein RASON encoded by a lncRNA controls oncogenic RAS signaling in KRAS mutant cancers. Cell Res (2022). https:// doi.org/10.1038/s41422- 022-00726-7











