把題主列的幾種現象單拎出來,不適應生肉,生殖困難,幼兒發育期長,似乎確實是 「不符合自然前進演化規律」的地方。
為了說明這個問題,按照題主的思路,我再列幾個人類「不符合自然前進演化規律」的地方。
1.心臟之殤
動脈粥樣硬化(Atherosclerosis) 是一種粥樣斑塊沈積在血管壁,造成動脈狹窄的疾病。它是引起人類 心臟病 的主要原因。
這種疾病由來已久,1575年就有文獻記載,而相關考古證據表明5000年前就有人類罹患粥樣動脈硬化的跡象;
這種疾病還很常見,每年全球約1800萬人死於心血管疾病,而粥樣動脈硬化是已開發國家致死致殘的頭號殺手。
然而就是這樣一種 歷史久遠,傳播範圍廣的疾病,卻只有在人類社會中出現 ,其他哺乳動物(包括與人類親緣關系很近的黑猩猩)中幾乎不存在。
為什麽會這樣呢?
這還要從一種CMAH基因說起。
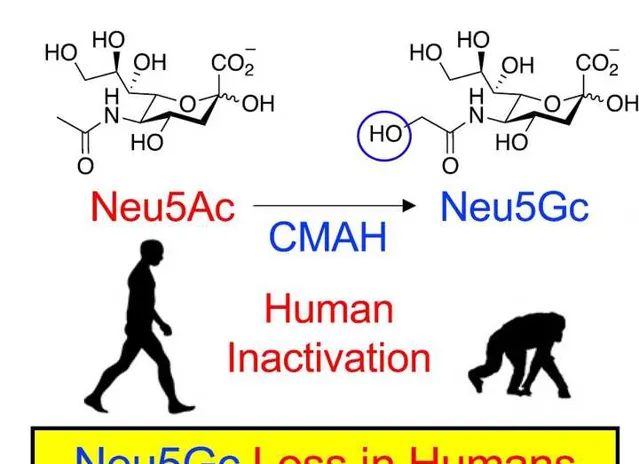
二三百萬年前,在和黑猩猩的前進演化序列分開以後, 人類遺失了一種基因——CMAH基因 ,這種基因編碼的酶能夠 將唾液酸Neu5Ac轉化為Neu5Gc 。由於人類缺失了CMAH基因,無法實作上述轉化,因此 天然情況下,人類體內是不存在Neu5Gc 。
但是現實情況中,人類體內的Neu5Gc可不少。
研究表明,人類食譜中的 豬肉、牛肉和羊肉等紅肉,是人體內Neu5Gc的主要來源 。
這就引發了一個重大問題,雖然Neu5Gc和Neu5Ac生化形態很像(只差一個羥基-OH),但它屬於外來分子,人體的免疫系統可不管你像不像,必須對你進行清理。隨著人類食用紅肉, Neu5Gc不斷進入組織 ,免疫系統內的Neu5Gc 抗體在Neu5Gc積累的地方引起慢性炎癥 ,而這些地方恰恰就包括了 血管內壁——粥樣動脈硬化的常見場所 。
當然除了慢性炎癥外,CMAH基因的缺失還透過多種內外機制, 增加了粥樣動脈硬化的患病機率 。
總之,人類前進演化的歷程上遺失了CMAH基因,也因此患上了高風險的粥樣動脈硬化疾病。
為什麽會有這樣不符合自然前進演化規律的情況出現呢?
2.黝黑膚色
皮膚的顏色主要取決於黑色素, 黑色素是一種有效的光吸收劑,能夠減少陽光紫外線放射線對皮膚的傷害。
過度暴露於陽光會導致 曬傷 ,紫外線放射線會破壞膠原纖維並加速皮膚老化,並且增加了罹患 皮膚癌 的風險。
另外對於 孕婦 來說, 紫外線放射線 還有個大問題—— 破壞葉酸 。
葉酸(Folate),也稱為維生素B9,是B族維生素之一。葉酸缺乏會限制細胞分裂,阻礙了紅血球生成,導致巨幼紅血球性貧血,人容易感到疲倦、呼吸急促、舌上長瘡等。
孕婦缺乏葉酸會增加胎兒早產,以及嬰兒神經管畸形的風險 。
而血液中的葉酸迴圈至皮膚表面時,容易被紫外線放射線降解。
因此,在陽光下暴曬時, 人體會生成和釋放黑色素,使皮膚變黑,修復損傷,保護皮膚。
在早期人類起源於非洲時,面對熾熱的陽光,黝黑的皮膚大大減少了紫外線放射線對人體的傷害。

那麽,既然紫外線放射線這麽可怕,黑皮膚這麽好,那不是皮膚越黑越好?為什麽不是每個人都是黑皮膚呢?還需要在暴曬的時候才變黑保護自己?
3.死神鐮刀
鐮狀細胞病(Sickle-cell disease) 是一種由雙親遺傳而來的血液疾病。
人類 正常的紅血球是圓餅狀 ,中心向內凹陷,胖胖的形態飽滿,並且很有柔韌性。但是鐮狀細胞病會引起紅血球中的載氧蛋白異常(HbS),使得 紅血球變成堅硬的鐮刀狀 。

鐮狀細胞病是體染色體 隱性遺傳疾病 ,如果父母均為患病基因攜帶者(Rr),那麽他們的後代有 1/4的機率為正常人(RR),2/4的機率為患病基因攜帶者(Rr), 1/4的機率為鐮狀細胞病患者(rr)。

其中 患病基因攜帶者(Rr)具有鐮狀細胞性狀,血液內既有正常的紅血球,也有鐮狀細胞,但表觀一般沒有異常癥狀。 而攜帶隱性純合子(rr)的後代血液內有大量的鐮狀細胞。
鐮狀細胞病患者會出現許多健康問題,包括疼痛、貧血、血管堵塞、手腳腫脹和中風等等。

據統計,截至2015年,全球約有440萬人患有鐮狀細胞疾病(約11.4萬人死亡),另有約4300萬人具有鐮狀細胞性狀。並且該疾病呈現明顯的區域分布特性, 大約80%的鐮狀細胞性疾病發生在撒哈拉以南的非洲 ,而在歐洲幾乎沒有出現。
這麽嚴重的疾病,為什麽在非洲如此頻繁地出現呢?自然選擇為什麽沒有將這部份基因淘汰呢?
看了上面三個「不符合自然前進演化規律」的事例,我再從另一個方面,講講關於CMAH基因、膚色和鐮狀細胞的故事。
1. 耐力之王

2019年10月12日,馬拉松之王基普喬格(Eliud Kipchoge)在英麗仕1:59挑戰賽中以1小時59分40.2秒打破非官方的世界紀錄,把人類馬拉松的成績提升到2小時以內。
雖然這是個比較極限的例子,但 人類確實是動物界耐力最強的物種之一 。

早期古人類沒有健壯的身體和先進的工具,爆發力也不強,他們在進行狩獵時,不能肉搏和遠端攻擊。
因此他們采用了一種稱為 永續性狩獵(耐力狩獵)的技術 ,獵人透過奔跑、步行和跟蹤,長時間追逐獵物,直到獵物筋疲力盡,癱倒在地。
這個技術的關鍵之處在於獵人比獵物具備更強大的耐力。
人類耐力強大的經典解釋來源於 解剖構造 和 生理適應 ,包括骨骼和肌肉的結構(例如臀大肌增大)、毛發減少和汗腺發達等。但是 遺傳變異方面的機理 尚未確定。

Jonathan Okerblom等人利用小鼠做了實驗,以研究CMAH基因缺失對耐力的影響。結果表明, CMAH基因缺失的小鼠奔跑速度比正常小鼠快12%,奔跑距離多20% 。同時,小鼠的 粒線體呼吸和後肢肌肉增強 ,表現出 對疲勞更大的抵抗力 。
總之,CMAH基因的缺失有利於小鼠提高耐力。
而人類在二三百萬年前,就缺失了CMAH基因,這可能 提高了人類祖先的耐力,創造了選擇優勢 。
2.雪白膚色
維生素D(Vitamin D,簡稱VD) 是人體必需的營養素,最重要的作用之一是 促進小腸粘膜對進鈣的吸收 ,保持血液內鈣和磷酸鹽的濃度,利於新骨生成和鈣化。
當人體缺乏VD時,會導致骨骼密度降低(骨質疏松),骨骼軟化,O(X)型腿等各類骨骼疾病。
人類體內,最重要的兩類VD是VD3與VD2。前者由7-去氫膽固醇(來源皮下組織)經紫外線照射而成;後者由麥角固醇(來源菌類)經紫外線照射而成。
因此, 人體內VD的主要天然來源是日曬(紫外線照射) 。一般來說,每次曬5-30分鐘,每周曬2次左右,人體就能產生足夠的VD。皮膚越黑,光照越弱,那麽就要相應增延長間。
另外,由於紫外線無法穿透玻璃,因此在室內 隔著玻璃窗做日光浴,並不能產生VD 。

所以, 白色的皮膚有利於紫外線穿透,促進VD的的生成 。
還有個有趣的事實,研究表明,在同樣條件下, 成年女性的皮膚總是比男性白 。這是因為女性在懷孕和哺乳期間, 需要大量的鈣 ,以支持胎兒發育和嬰兒哺乳的需求,並且維持自己的健康。
3.瘧疾克星
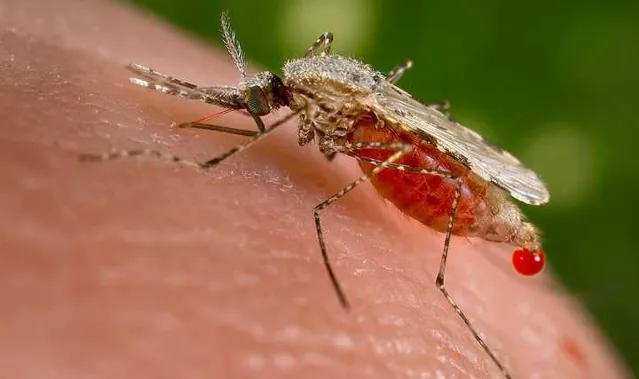
瘧疾(Malaria) 是一種被瘧原蟲感染的疾病,最常見的是 透過雌性按蚊傳播 ,蚊子叮咬將其體內的瘧原蟲傳入人類血液,瘧原蟲隨血液迴圈移動至肝臟,在肝細胞中大量繁殖。
經過一段潛伏期後, 瘧原蟲 會產生大量的裂殖子,破壞肝細胞進入血液,開始 侵入紅血球,在紅血球內繁殖、破出 ,繼續周期性地侵犯更多的紅血球。
被瘧原蟲感染後,一般會在8-25天出現癥狀,包括發熱、畏寒、頭痛等一系列問題。而腦瘧疾患者會產生神經系統疾病,出現姿勢異常、共軛凝視麻痹(眼球無法朝向同一方向轉動)、抽搐昏迷等嚴重病癥。

該病廣泛分布於熱帶和副熱帶地區,包括撒哈拉以南非洲和拉丁美洲的大部份地區。2016年,全世界有2.16億瘧疾病例,估計導致44.5萬至73.1萬人死亡,而 大約90%的病例和死亡都發生在非洲 。
面對疾病的重大挑戰,非洲人民是如何生存下來的呢?
可以說, 瘧疾帶來的高患病率和高死亡率,造成了人類近代以來最大的演化壓力 。在自然選擇上,一些基因被篩選出來。
攜帶鐮狀細胞基因的人,血液內部份紅血球變異呈鐮刀狀,這種細胞輸氧效率低,缺乏彈性,壽命較短,因此寄居的 瘧原蟲往往沒有足夠的時間發育成熟,無法正常繁殖,抑制了瘧原蟲的數量。
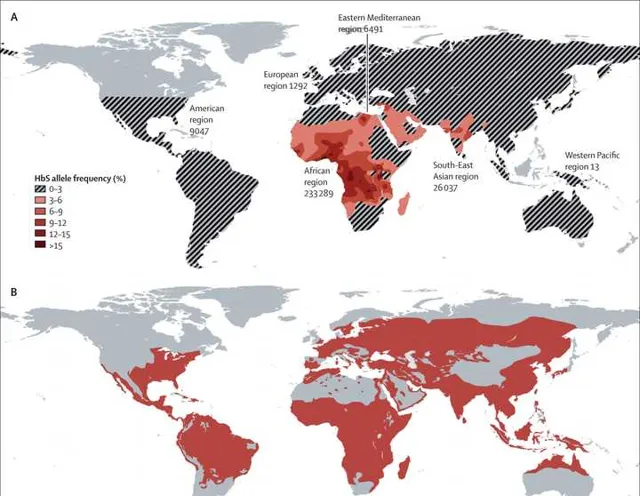
因此在 瘧疾高發的非洲地區,攜帶鐮狀細胞基因的人也非常之多 ,鐮狀細胞病和瘧疾的分布區域幾乎重合。
鐮狀細胞所造成的疾病和對瘧疾的抗性,充分展現了人類在演化上為生存所做的權衡。
簡單小結一下:
CMAH基因雖然使得人類受粥樣動脈硬化的困擾,但是提高了人類的耐力;
黝黑的皮膚雖然保護人體不受紫外線傷害,但是一定程度阻礙了維生素D的合成;
鐮狀細胞病雖然在非洲廣泛存在,但是提供了針對瘧疾的抗性。
因此,看似「不符合自然前進演化規律」的地方,其實背後有更深層次的原因,恰恰表明了 人類在前進演化上的適應,對生存的綜合考量。
自然前進演化規律並不是造就完美的生物,而是選擇最適應當前環境的生物。
針對題主提出的「生殖困難」等問題,也是類似情況,大家有興趣,我再來補充參考文獻:
【1】Okerblom Jonathan, Fletes William, Patel Hemal H., Schenk Simon, Varki Ajit and Breen Ellen C. Human-like Cmah inactivation in mice increases running endurance and decreases muscle fatigability: implications for human evolution285Proc. R. Soc. B
【2】KAWANISHI, Kunio, et al. Human species-specific loss of CMP-N-acetylneuraminic acid hydroxylase enhances atherosclerosis via intrinsic and extrinsic mechanisms. Proceedings of the National Academy of Sciences, 2019, 116.32: 16036-16045.
【3】Jablonski N G , Chaplin G . The colours of humanity: the evolution of pigmentation in the human lineage[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2017, 372(1724):20160349.
【4】HEDRICK, Philip W. Population genetics of malaria resistance in humans. Heredity, 2011, 107.4: 283.
【5】Rees, DC; Williams, TN; Gladwin, MT. Sickle-cell disease.. Lancet (London, England). 11 December 2010, 376 (9757): 2018–31. PMID 21131035. doi:10.1016/s0140-6736(10)61029-x.











