这两天备课「化学势」,看了点朗道的书,难免就被带得往那边偏了。但不得不承认,朗道式思想确实好用!
- 首先,没平衡的时候,不能应用热力学!书中的公式完全不成立。任何公式都是有前提条件的。这个问题反映出提问者的热力学的基本假设没学明白,靠刷题是无法真正理解一套理论的。我昨天讲的的时候,听到有学生窃窃私语:「我电动力学没学,靠刷习题册过的考试」。这种学习方法让我非常震惊。曹原开发魔角石墨烯有习题集吗?爱因斯坦提出相对论,是因为他有一本」相对论习题集「,他把习题集刷到100分,然后就提出相对论了吗?世界上舍本逐末的事情还真是多啊。。。。。。
2. 考虑一下平衡的时候会发生的情况。根据半经典的统计力学理论,化学势来自于:
\mu = -k_{\rm{B}} T \ln Z_{1}
对于理想气体,有:
\mu = -k_{\rm{B}}T \ln \left[ \frac{Ve}{N} \left(\frac{2\pi m k_{\rm{B}}T}{h^2}\right)^{3/2} \right]
换用温度和压强作为自变量,就有:
\mu = -k_{\rm{B}}T \ln \left[ \frac{k_{\rm{B}}Te}{P}\left( \frac{2\pi m k_{\rm{B}}T}{h^2} \right)^{3/2} \right]
从这个地方可见, P\to 0 ,化学势趋于负无穷。貌似出现了反直觉的效果。
但是,这里有个问题,就是保持温度不变,压强要降低,必须改变体积。而保持温度不变改变体积不能让体积无限膨胀下去,因为要有环境给它供热。
另一种思路是保持体积不变,用改变温度的方法改变压强。我的经验是,P 和温度成简单幂次关系,这时候,把化学势里的温度用压强和体积表示,有:
\mu = -P^{\alpha}V^{\lambda} \ln \left[P^{\alpha'}V^{\delta}\gamma \right]
而在有限的幂次下,有: \lim_{x\to 0} x^{\alpha} \ln x^{\alpha'} = 0 ,即化学势仍然是有限的。
3. 另外,根据上述讨论,保持体积不变令 P\to0 时,温度也趋近于零。由于零点能的存在,温度不会降到绝对零度,同理压强也不会降为零。而且这时候需要考虑全同粒子性,并考虑讨论的是玻色子还是费米子。对于理想费米子气体,其零温下化学势存在极大值;而对于理想玻色子,由于玻色-爱因斯坦凝聚的存在,其极限值为 0 。总之是不会跑到无穷大去。
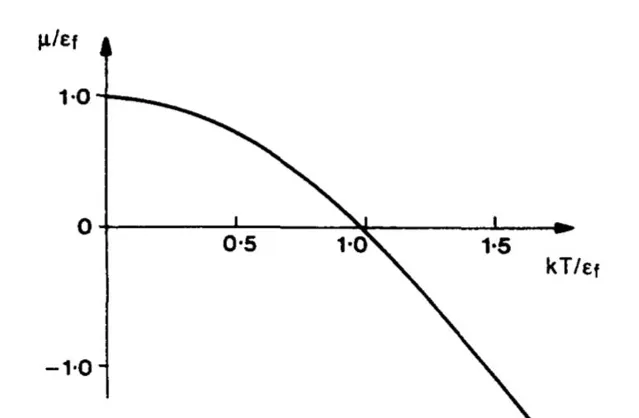
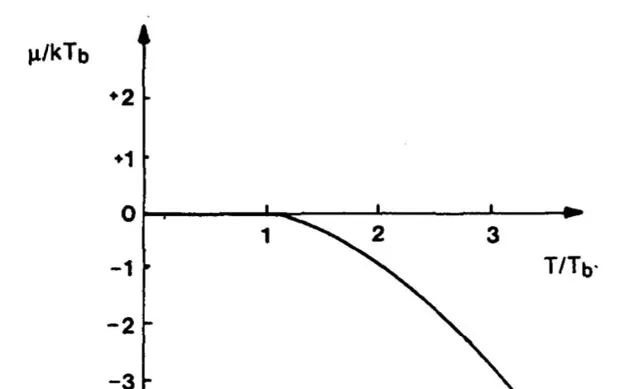
图来自于文献:G. Cook & R. H. Dickerson, 「Understanding the Chemical Potential」, Am. J. Phys . 63 , 737 (1995)
4. 对于 自由 光子、 自由 声子等玻色子,由于粒子数不守恒,其化学势一直为零。
5. 还有如果粒子数过少,热力学公式就失效,回到经典力学或量子力学。











