溶質與溶液之間的溶解過程是 涉及到分子間作用力的 。涉及到溶質與溶液的性質,常規會把溶液粗淺分為兩種,極性溶液和非極性溶液。我們所熟知的「相似相容原理」,其實本質就和分子間的作用力有關系。
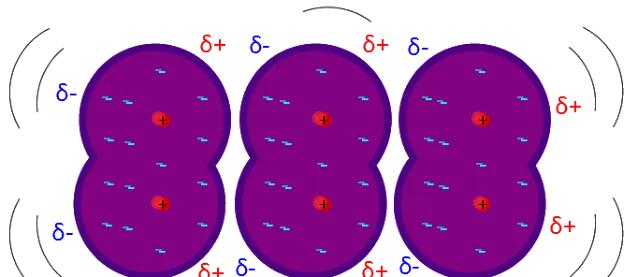
粗淺的分類,分子間作用力可分為範德華力和次級鍵,在這裏就不在詳細介紹,詳細可見我曾經寫的一篇文章 [1] 。聊聊分子間作用力的那些事兒
當非極性氣體溶解於溶劑中時,主要依靠溶質分子與溶劑分子間的 色散作用 ,即使在極性溶劑中誘導作用的貢獻也是很小的。因此,當氣體分子的極化率增加時溶解度也相應地增加。溶劑性質的影響要復雜一些,當溶劑的極化率增大時,雖然有利於溶質和溶劑的相互作用, 但是溶劑分子間的相互作用也增強了,這又不利於溶解。
一般來說,極性物質在非極性溶劑中的溶解度比較小,而在極性溶劑中溶解度則較大。反之非極性物質則比較容易溶解於非極性溶劑中,在極性溶劑中的溶解度則較小。 極性與非極性物質形成的溶液,往往是正偏差,其蒸氣壓高於理想溶液值,沸點則降低。
氫鍵的形成對混合物性質有顯著影響 。例如氯仿、乙炔能很好地溶解於乙醚、丙酮中,因為它們之間實質上是形成了絡合物。但是對某些物質則視形成絡合物以及它們的自締合強度的差異而定。 例如氯仿就能很好地溶解於甲醇中,是因為氯仿與甲醇的作用強於甲醇的自締合。
但是氯仿卻很難溶解於水中,是因為水的 自締合 太強了。而二氧六環(1,4-二氧己環)卻能溶於水中,說明它作為一個質子受體,其強度大到可以與水競爭。 氫鍵的形成或破壞將使溶液的蒸氣壓與沸點偏離理想。
例如乙醇自締合很強,當溶解於四氯化碳中後,由於稀釋,使締合度降低,因而蒸氣壓升高,並形成最低恒沸點。而丙酮與氯仿由於生成絡合物,蒸氣壓降低,形成最高恒沸點。
但是對某些物質混合時情況就比較復雜,例如,二氧六環與醋酸,一方面它們之間形成分子間氫鍵使蒸氣壓下降,另一方面醋酸自締合的解離使蒸氣壓升高,在這個例子中,兩者競爭的結果蒸氣壓仍下降,形成最高恒沸點。當然,氫鍵只是原因之一,其它類別的分子間力的影響也應重視。
在這裏提一嘴,混合時的熱效應當然也應該與分子間力特別是氫鍵和電荷轉移有關。一般來說,生成分子間絡合物是放熱的,而自締合的解離則是吸熱的。
有朋友 @天天向上 還提到的鹽的溶解過程,這個很好,這時候得考慮到溶劑化的作用。
這就屬於離子鍵了,化學鍵的範疇,對於兩個帶電離子 e_{i} 和 e_{j} ,如果介電常數為 D ,那麽兩個離子間的作用力 f 和位能 \varepsilon_{p} 可以表示為:
\begin{array}{c} f=\left(e_{i} e_{j}\right) /D r^{2} \\ \varepsilon_{p}=\int_{r}^{\infty}\left(e_{i} e_{j}\right) / r^{2} d r=\left(e_{i} e_{j}\right) /D r \end{array}
離子間靜電力與距離平方成反比,它是一種長程力。可以說鹽類晶體中的離子,就是靠這種作用力牢固地結合在一起。但是在水中,鹽類卻能輕易地被溶解,離子都可以在水中「四處亂竄」,完全不受到這種很強的力的影響。在水中,由於水的介電常數 D 很大(25℃時為78.53),靜電力大為減弱,能夠使離子分散在水中,而形成溶液。當然,如果水溶液中離子濃度很大的話,離子之間的相互作用力就會增強。
參考
- ^ 聊聊分子間作用力的那些事兒 https://zhuanlan.zhihu.com/p/196644117










