肌萎縮性脊髓側索硬化癥(ALS)是一種以運動系統退化為主要特征的疾病,臨床證據表明,多達50%的病例出現認知和行為改變。ALS在臨床上和生物學上都是異質性( 一種遺傳性狀可以由多個不同的遺傳物質改變所引起 )的。目前使用臨床參數進行亞分組,如癥狀出現的部位(延髓或脊柱)、疾病負擔和家族性疾病患者的基因組學。然而,除基因組學外,這些亞分類沒有考慮潛在的疾病病理生物學,不能完全預測疾病的病程或預後。
最近,我們已經證明靜息狀態腦電圖可以可靠和定量地捕捉肌萎縮側索硬化癥中運動和認知網絡的異常模式。這些網絡中斷已在多個頻帶上被辨識出來,並使用對高密度腦電圖(EEG)源局部振蕩的神經活動(頻譜功率)和環通度的測量來辨識。使用數據驅動的方法(相似網絡融合和頻譜聚類),我們現在進行了 聚類分析, 以確定疾病亞表型,並確定不同的中斷模式是否可以預測疾病的結果。我們發現ALS患者(N=95)可細分為 四種具有不同神經生理特征的表型。 這些聚類的特征是 初級軀體運動皮質(α波段同步)、額顳(β波段神經活動和γ1波段同步)和額頂葉(γ1波段共調制)網絡的不同程度的破壞, 這些網絡可靠地與不同的臨床特征和不同的疾病軌跡相關。透過深入的穩定性分析,我們表明這些聚類在統計上具有可重復性和魯棒性,在使用隨訪腦電圖再次評估後仍保持穩定,並可以預測臨床軌跡和疾病結果。本文發表在BRAIN雜誌。
1.介紹
肌萎縮性脊髓側索硬化癥(ALS)是一種異質性的神經退行性疾病,主要影響運動系統,導致不同程度的上、下運動神經元功能障礙,同時累及運動外區域, 表現為認知和行為障礙,與額顳葉癡呆(FTD)重疊。 肌萎縮性脊髓側索硬化癥患者在臨床表現和預後方面都是異質性的,其潛在的疾病病理生物學也具有可變性。目前的臨床表型基於癥狀發生的主要部位(脊髓、延髓、呼吸道)、家族史和上下運動神經元受累的相對程度(上下運動神經元為主)。此外,ALS患者也通常根據生存期(短、平均和長)進行分類。使用結構和功能MRI、PET和神經生理學(腦電圖和肌電圖)數據尋找與臨床亞組相關的定量測量。
ALS臨床表型的其他改進包括行為亞表型的詢問、早期臨床咨詢的數據以確定生存概率範圍和基因組特征。至少有30個已確定的基因和三個主要的病理生理過程(如RNA生物學、蛋白質轉換和軸突轉運)與ALS有關。綜上所述,這些觀察結果,以及肌萎縮性脊髓側索硬化癥相關基因之間缺乏明確的相關性,以及高度獨特的分子神經病理和臨床亞型,表明肌萎縮性脊髓側索硬化癥不再被視為具有單一病理生理和臨床過程的單一疾病。
目前的影像學和神經生理學證據表明, 以生物病理學和遺傳因素為基礎的神經網絡的差異破壞可能反映了異質性的臨床表現 。使用現有的臨床工具,如測量運動功能減退的經修訂的ALS功能評定量表(ALSFRS-R),以及檢測認知和行為變化的愛丁堡ALS認知和行為篩查量表(ECAS),無法完全辨識這種差異。
腦電圖(EEG)可以在網絡水平上為不同的神經退行性疾病相關的功能變化提供額外的見解。使用這種方法與基於任務的範例,我們已經發現了影響額頂網絡功能障礙的變化。此外,我們已經證明了靜息狀態腦電圖,它可以提供反映大腦不同過程的不同測量,可以 定量地捕捉肌萎縮側索硬化癥影響的運動和認知網絡。 更具體地說,使用傳感器空間分析,我們發現 靜息狀態的腦電圖變化與MRI的結構變化相關, 並與其他腦電圖研究一致。在一項後續研究中,使用先進的源空間分析,我們進一步描述了功能障礙網絡,並透過結構MRI和臨床數據證實了這一發現。
在這裏,我們假設,可以 根據網絡中斷的模式來辨識患者亞組, 這些模式可以用來揭示對治療的潛在不同反應。我們展示了腦電圖測量活動和大腦網絡的連線性如何為形成ALS患者的穩定集群以及與這些患者集群相關的獨特的神經生理特征提供資訊。
2.方法
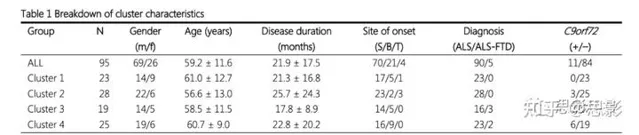
共95例ALS患者:70例脊柱起病,21例患者出現延髓病變和呼吸發病4例,還有77個健康的對照組。5例患者被診斷為ALS-FTD,11例患者C9orf72基因的六核苷酸重復擴增。
實驗采集了每個被試3段2分鐘的靜息態數據,腦電采用128導腦電帽(BioSemi B.V., Amsterdam, The Netherlands)。隨後我們在帶通(1-97Hz)濾波EEG數據上套用 fieldtrip裏的線性約束最小變異數波束形成器, 根據自動解剖標記圖譜獲得來自90個大腦區域(不包括小腦)的時變訊號。利用90個源重構訊號,我們估計了歸一化譜功率、振幅包絡相關和同步(虛相幹)。估計每個區域的頻譜功率,同時估計每對大腦區域之間的共調制和同步,從而得到90×90對稱連線矩陣,其中4005(90×89/2)連線特征是唯一的。這三個測量在 六個頻段: δ(2-4 Hz),θ(5-7 Hz)、α(8-13 Hz)、β(14-30 Hz)和γ(γ1: 31-47 Hz,γh: 53-97 Hz)。
在沒有預先了解肌萎縮性脊髓側索硬化癥患者的EEG特征的情況下,我們選擇了一種無監督聚類方法並套用於所有可用的EEG特征。首先,使用 相似網絡融合(SNF)方法 組合和制備高維數據集,然後使用頻譜聚類。為準備聚類前的數據,對每個EEG特征進行z分數變換。基於歐氏距離構造3個患者相似矩陣(每組EEG特征1個), 采用多個高斯核將其融合為一個相似矩陣。 SNF方法使用來自其他矩陣的資訊叠代更新每個矩陣,從而融合互補資訊。為了消除累積雜訊中出現的患者之間的不相關關聯,使用 網絡增強方法 對融合的相似性矩陣進行去噪。最後,使用譜聚類對患者進行亞分組。
補充說明: 對於這三種EEG測量,使用高斯核構造一個單獨的患者相似度(或親和力)矩陣:
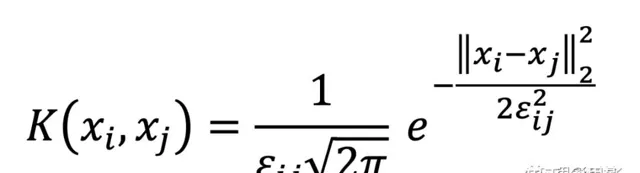
其中
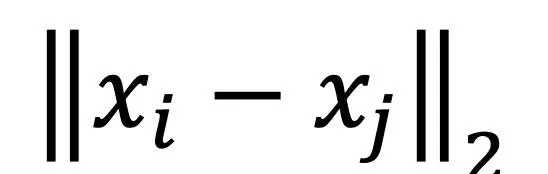
是歐氏距離。
然後,使用相似網絡融合(SNF)方法將三個患者相似矩陣(每個患者測了三段)合並為一個,這是一種 非線性方法, 基於多個獲取患者不同特征的資料來源建立一個統一的患者檢視。
每個參與者都定義了90個「腦電圖網絡」,這些網絡是基於已知的在靜息時被啟用並在肌萎縮側索硬化中受到影響的網絡。即在6個頻帶內分別對5個解剖網絡( 軀體運動網絡、額顳網絡、額頂葉網絡、預設模式網絡和突顯網絡 )的譜功率、共調網絡和同步網絡進行平均,構建90個網絡。對於每個組合(即「EEG網絡」),使用AUC( 受試者工作特征曲線下的面積 )將每個ALS聚類與對照數據進行比較。
獲得的AUC值然後用於確定與每個確定的集群強烈且相關的大腦網絡。如果腦電網絡與對照組相比在統計上顯著,與其他組相比其變化獨特或方向相反,則認為腦電網絡是一個集群的潛在和排他特征。在這裏,我們報告了最具特征的腦電圖網絡受影響的每個集群。
采用運動功能障礙(ALSFRS-R)、認知功能障礙(ECAS)和行為功能障礙(BBI)評分對各亞組的臨床特征進行比較。為了評估得到的EEG聚類是否簡單地再現了可以直接從臨床數據中得到的亞型,我們對N = 60例具有完整臨床數據集的患者進行了聚類。
3.結果
腦電圖測量辨識四組ALS患者
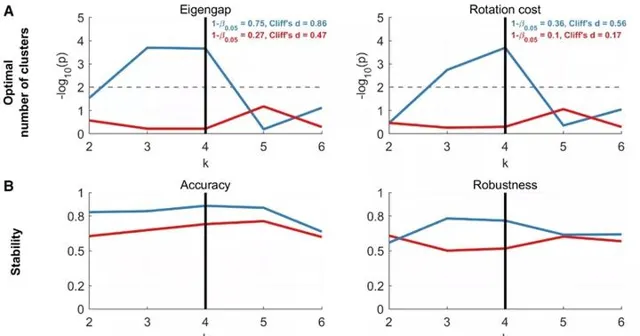
透過分析腦電圖頻譜的神經活動和環通度, 辨識出4個不同的聚類 (圖1),四個聚類的解具有較高的統計冪(分別為0.85和0.52)和較大到中等(分別為0.92和0.69)的效應大小,表明結果具有可重復性。所確定的集群的人口統計資訊如表1所示。
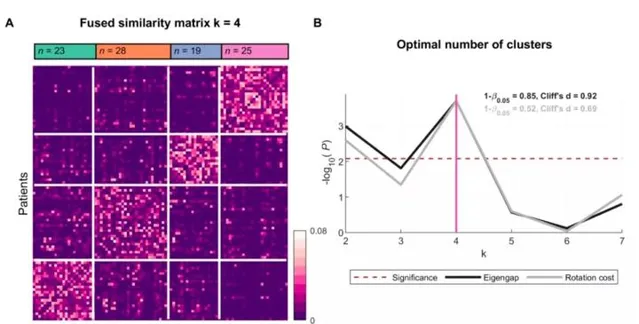
圖1腦電圖測量辨識了四個ALS聚類:融合相似矩陣和ALS聚類的最優數量。(A)基於聚類對ALS患者的融合相似性矩陣進行分類,並使用譜聚類進行辨識。(B)k=4時,兩種測量都反映最佳聚類數達到最高的顯著性。
表1聚類特征分解
腦電圖顯示了不同的神經生理特征
基於腦電圖測量的四個聚類的神經生理特征分析顯示, 每個聚類的神經網絡明顯受損 (圖2)。例如, 聚類1在額顳葉網絡中表現為β波段頻譜功率增加的特征,而聚類3和4在同一網絡中表現為功率降低。 類似地, 聚類2表現出軀體運動網絡中α波段同步性增強的特征,聚類3表現出額顳網絡中γl波段同步性減弱,聚類4表現出額頂葉網絡中γl波段共調制性增強。 Kruskal-Wallis單向變方分析表明, 這四種網絡在不同的集群之間存在顯著差異。
與所有四個聚類相關的腦電圖異常被確定為初級軀體運動皮質和額顳腦區域的調節增加(δ-α波段振蕩)和同步性減少(δ-β波段振蕩) (見補充圖1)。
圖2: 對於每一個聚類,使用ALS聚類和控制數據之間的AUC統計估計來確定一個獨特的神經生理變化(大腦網絡、頻帶和腦電圖測量)。在這四種情況下,集群之間的網絡差異很大。線上性模型分析的基礎上,拒絕了年齡和性別對所辨識的變化的潛在影響。 AUC: 特征曲線下以零為中心的面積;與健康對照組相比, 正值表示增加,而負值表示減少。
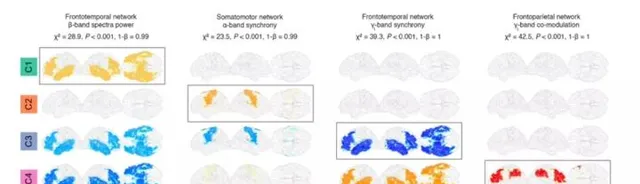
圖2肌萎縮性脊髓側索硬化癥群不同的神經生理特征
補充圖1:腦電圖代表了使用所有ALS患者(第一個面板)和每個分組(面板2-5)分別與健康對照組進行的頻譜測量( A:頻譜功率,B:調制和C:同步 )的統計比較。第一個面板反映了四個組共有的腦電圖變化 ,而其他面板反映的腦電圖異常, 在不同的集群顯著不同。

補充圖1肌萎縮性脊髓側索硬化癥集群的完整神經生理特征
除了臨床亞表型外,聚類與總生存率的顯著相關。生存概率曲線(圖3C)顯示,聚類4的生存概率最短(中位數:~3年),而聚類2的生存概率最長(~6年)。圖3:四個腦電圖組(顏色編碼)表明不同領域的功能/臨床評分有不同的趨勢:
(A)歸一化ALSFRS-R(延髓、肢體和呼吸)和(B)z得分ECAS(語言、流暢性、執行力、記憶和視覺空間)和歸一化BBI(行為)得分均不顯著。(C)ALS組對應的Kaplan-Meier生存曲線。(D-F)臨床特點。
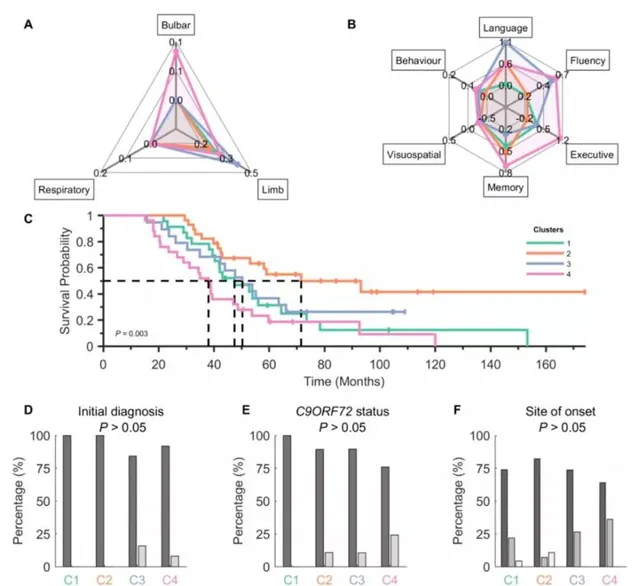
圖3腦電圖測量得到的ALS群的臨床特征與神經生理特征一致
雖然聚類與常用的臨床分層參數(初始診斷類別、發病部位和C9orf72基因狀態;圖3D-F)不顯著,但是結果與群集的臨床特征一致。具體來說,聚類3和聚類4(在大多數認知子評分中,這兩個組的損害程度最大;圖3B)包括所有初始診斷為ALS-FTD的患者。此外,與類別2和3相比,類別4 C9orf72陽性患者的比例最高。
在疾病持續時間、King分期、年齡、性別或使用利魯唑方面,組間沒有顯著差異,這可能影響腦電圖測量和報告的結果(補充圖2)。此外,我們證明King分期不能解釋腦電圖網絡辨識的集群,也不能解釋腦電圖集群中進展模式的差異(補充圖3)。線上性模型分析的基礎上,測試和拒絕年齡和性別對神經生理特征變化的潛在影響。
補充圖2: 比較四個確定的聚類(顏色編碼)使用(A)功能得分在不同的領域,包括ALSFRS-R(延髓、肢體和呼吸)、ECAS(語言、流暢性、執行力、記憶和視覺空間)和BBI(行為)得分;(B)從發病報告時間到腦電圖記錄日期測量的疾病持續時間;(C)反映疾病負擔的King分期(1-4期,早期-晚期);(D-F)年齡、性別和利魯唑用法。
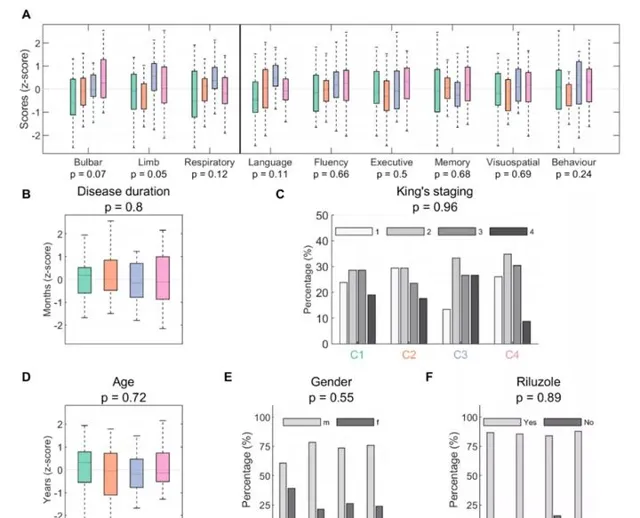
補充圖2 ALS聚類的臨床概況和可能影響聚類結果的潛在因素
補充圖3: (A)四個King亞組(顏色編碼)在正常的ALSFRS-R(延髓、肢體和呼吸)中顯示有統計學意義差異,但在(B)z評分的ECAS(語言、流暢性、執行力、記憶和視覺空間)和正常的BBI(行為)中沒有差異。(C) Kaplan-Meier生存曲線和(D-F)臨床特征。
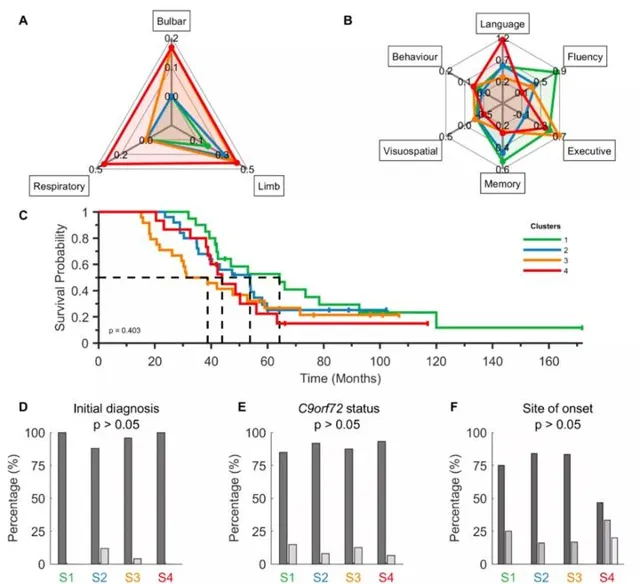
補充圖3肌萎縮性脊髓側索硬化癥患者按King分期分組並沒有不同的生存概率
患者群集在多次測試中顯示穩定性
進一步分析表明,各聚類具有較高的準確性和穩健性,重估時保持穩定。具體來說,基於Louvain局部檢測方法的聚類解收斂到相同的聚類數(k=4),並且與主分析的頻譜聚類解有很高的重疊,其中只有7例患者被不同分配。此外, 估計的聚類精度達到89%, 穩健性分析表明,在存在數據擾動的情況下,82%的聚類標簽保持穩定。最後,使用縱向數據集,總體聚類分配為72%(圖4),表明發現的聚類具有實驗穩定性。圖4:總體穩定性為72%,具有統計學意義。隨訪患者總數N=36。
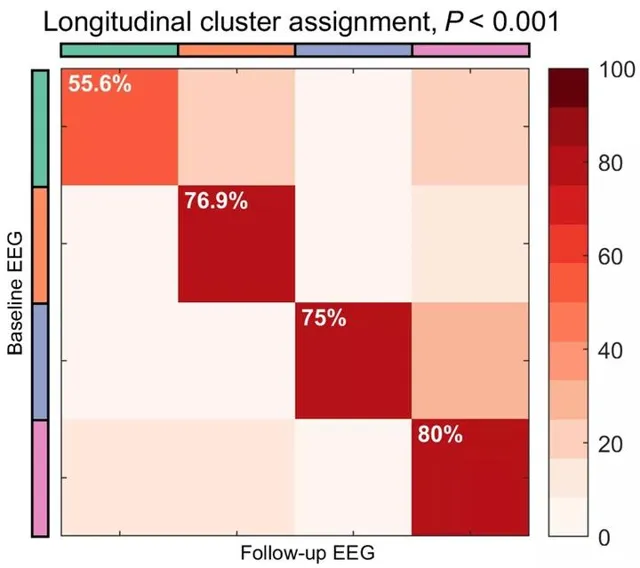
圖4集群表現高穩定性
僅基於臨床數據的聚類不能確定穩定的亞組
采用相同的方法,將所有臨床指標進行合並,並對指標進行統計分析,以估計最佳聚類數量。沒有發現顯著的聚類,這表明 普遍套用的臨床決定因素並沒有驅動神經生理聚類數據 (見補充圖4)。
補充圖4與腦電圖數據相比,基於臨床數據的ALS聚類的最優數量和聚類解的穩定性
4.討論
我們已經證明,使用多維定量腦電圖分析網絡幹擾可以辨識ALS中使用標準臨床評估工具無法發現的子組。每一個亞組,透過數據驅動的聚類辨識,展示了一個獨特的神經生理學輪廓,反過來概括了不同的臨床內容組合。這些神經生理特征在重新評估時是穩定的,並與不同的預後結果相關。
已辨識的腦電圖聚類表征了不同的腦網絡損傷
臨床異質性已成為理解神經退行性疾病病理生理學的主要障礙。這對藥物開發有影響,因為臨床分層參數作為疾病進展和生存的預測因素仍然相對不敏感。雖然我們確定的集群的網絡中斷特征與通常定義的疾病臨床表型亞型沒有很強的相關性或重疊,這並不令人驚訝,但我們的結果與以前研究的觀察結果一致。例如,本研究的聚類4中C9orf72患者比例最高,已知C9orf72可累及額顳、顳頂和皮層下腦組織和EEG改變,並常與認知和行為障礙相關。因此,在我們的研究中,這一聚類的神經生理特征是 額頂葉網絡 (也稱為中央執行網絡)內的γl-波段共調節的顯著異常變化,而這一聚類的臨床特征顯示了 顯著的語言流暢性障礙。 類似的,這一群組有最多比例的延髓病變患者,MRI研究顯示額顳葉,顳頂和皮層下的大腦區域廣泛變薄。此外,雖然聚類4有最高比例的C9orf72擴充套件患者,這與ALS和FTD都相關,但聚類3和4包括所有ALS-FTD患者。與其他研究一致,在我們的分析中, 這兩種腦電圖表型顯示最低的生存概率。 考慮到這兩組患者在認知和行為方面明顯增加的功能障礙,這些ALS患者的臨床特征可能與ALS-FTD頻譜中的FTD側一致。然而,C9orf72患者沒有形成一個單獨的聚類。這些發現證實了目前在ALS分類系統中使用的變量(例如基因突變狀態和FTD的存在/不存在)的復雜性和異質性。相比之下, 由腦電圖測量得出的亞型超越了ALS患者的傳統分類系統, 並在每個亞組中表現出不同的大腦網絡特征。
我們的發現與之前對ALS的神經電磁研究一致。例如,最近一項靜息狀態腦磁圖(MEG)連線研究報告稱,大腦後部的寬頻共調制增加。此外,利用圖論研究大腦網絡拓撲結構的研究顯示,發散的MEG γ-同步(透過相位滯後指數評估)影響全域大腦模式,而增加的EEG γ-同步(透過部份定向相幹性評估)影響額葉網絡模式。這些靜止狀態的發現與集群3和集群4中辨識的連線模式一致。
聚類1和聚類2的神經生理特征分別指向β帶額顳葉和α帶運動網絡的特征變化,而相應的語言、語言流利性和運動區域的臨床評分表明 這些功能相對保留。 這些異常的網絡啟用可以歸因於拓撲彈性或每個集群特有的主動補償機制,也可能是目前臨床工具不夠敏感。我們的工作強調,當ALS患者與對照組作為單一組進行比較時, 並非所有的群體特異性模式都可以辨識。 這是由於不同群體之間的損害模式的差異。 確認的β波段功率變化表明兩種不同的模式, 這可以解釋MEG研究報告肌萎縮性脊髓側索硬化癥患者 皮層β去同步化增加和腦電圖研究報告差異減少或沒有差異之間的矛盾。 此外,利用圖論研究大腦網絡拓撲的靜息態研究結果顯示, 腦電圖α同步性(透過部份定向相幹性評估)和α波段調制性增加主要發生在大腦中央區域。
臨床意義
我們已經證明,基於大腦網絡中斷模式的集群與臨床內容和疾病進展率的可重復聚集相關,證實了我們的研究結果的臨床相關性。以腦電圖為基礎的具有優越統計能力的亞型並不能概括所有的臨床數據。這表明, 這些神經生理模式提供了額外的資訊, 這是由臨床評估單獨辨識。以腦電圖為基礎的聚類在統計學上是穩健的,具有不同的模式,而單獨的臨床評分不能形成有意義的顯著聚類。更深入的分析,進一步探索腦電圖和臨床觀察之間的聯系,將需要更大和詳細的臨床和基因組數據集。
這種具有高統計力的穩定亞型的鑒定具有顯著的生物學和臨床意義。我們的發現可能有助於修改現有的分層系統,這是純粹基於臨床觀察。事實上,模擬分析對新患者產生了較高的分類準確率(89%),即將個體患者分類為聚類,這表明我們的聚類方法有潛力在個體患者水平上提供有臨床意義的發現。雖然決定這些模式或網絡破壞的潛在神經生物學過程在這一點上不能被辨識,集群的穩定性可以反映出網絡功能和完整性的病態前模式。
5.局限性
本研究的局限性在於其單一位點的性質。可能存在超過四個聚類的替代解決方案,特別是如果在聚類分析中包括更多復雜的神經生理測量。盡管有這些局限性,我們對聚類解決方案的保守驗證分析表明,這些結果是穩定的和可重復的。
將我們的研究結果轉化為臨床需要具有相同或更少EEG電極數量的醫療級器材(例如,來自10-20系統的32或19個),這需要進行額外的驗證研究。雖然這可能減少準備時間,但應謹慎處理研究表明, 少於32個傳感器的電極陣列會導致嚴重的定位錯誤。 此外,我們的神經生理概況包括γ波段的發現,在這種情況下,減少電極的數量可能對我們捕捉這些振蕩的能力有負面影響。然而, 由於定位精度從64個通道開始趨於穩定,醫療級別的64個通道的系統可以被視為未來的候選系統。
如需原文及補充材料請添加思影科技微信:siyingyxf或18983979082獲取,如對思影課程及服務感興趣也可加此微訊號咨詢。另思影提供免費文獻下載服務,如需要也可添加此微訊號入群,原文也會在群裏釋出,如果我們的解讀對您的研究有幫助,請給個轉發支持以及右下角點選一下在看,是對思影科技的支持,感謝!