酒精使用障礙(Alcohol use disorder, AUD)是一種慢性腦部疾病,其特征是消極、負性的情感狀態(負性情緒)、過量的酒精攝入。目前對於AUD共病負性情緒患者的治療手段及策略十分有限。
溶血磷脂酸(LPA)是甘油磷脂訊號分子的重要成員,主要由溶血磷脂酰膽堿(LPC)在溶血磷脂酶D的水解作用下生成,並透過G蛋白偶聯受體LPA1-6發揮重要的調控作用;LPA-LPA1訊號在中腦邊緣系統和背側間腦傳導系統中表達豐富,調節興奮/抑制性神經遞質的動態平衡。
外側韁核(Lateral habenula,LHb)可調節多巴胺能和血清素能系統,是連線前腦和中腦單胺能神經核團的一個重要樞紐。LHb核團內的谷胺酸傳遞系統功能增加與AUD共病負性情緒至關重要。
基於以上研究背景, 中山大學醫學院付饒副教授團隊 於2023年4月14日在Neuropsychopharmacology雜誌發文,揭示了 外側韁核中的LPA-LPA1訊號參與調節與AUD相關的負性情緒狀態 。

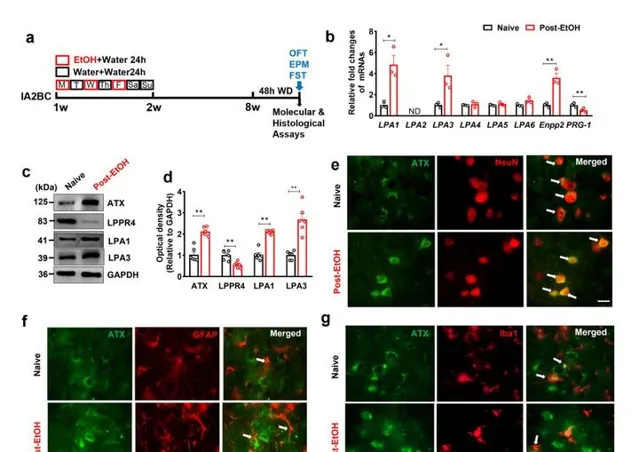
該研究建立了 間歇性進入兩瓶選擇性範式飲酒(Intermittent access to 20% ethanol two-bottle free choice drinking, IA2BC)模式的Long-Evans大鼠模型,慢性飲酒8周後對大鼠進行48小時急性酒精戒斷(Post-EtOH) ;透過一系列行為學測試明確LE大鼠表現出明顯的焦慮及抑郁樣改變;使用免疫熒光染色、分子生物學技術明確了與皮層和海馬組織相比,LHb內LPA的主要生成酶-ATX( Enpp2 )的表達量明顯增高,提示LHb是LPA的主要來源核團;ATX訊號(ATX與NeuN、vGlut2共標)主要定位於LHb谷胺酸能神經元的細胞膜,且ATX的表達在Post-EtOH大鼠LHb中增多,在細胞膜上的分布從點狀變為片狀,表達範圍增大;明確Post-EtOH大鼠LHb中,LPA代謝紊亂,表現為ATX/ Enpp2 的蛋白/mRNA水平顯著增加,水解酶LPPR4/ PRG-1 水平顯著降低;LPA1和LPA3受體較Naïve大鼠表達增多。
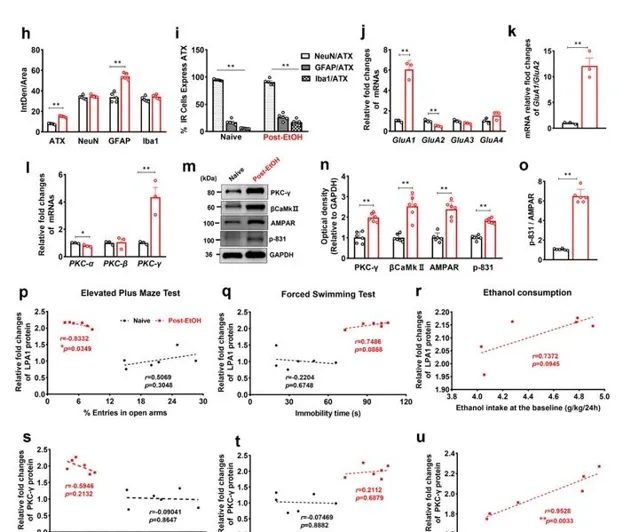
透過免疫組化技術,發現Post-EtOH大鼠LHb神經元強表達c-Fos,且c-Fos與ATX的共標率可達65.25%±3.50%;分子生物學實驗發現:PKC激酶γ亞型在LHb中表達豐富,且在Post-EtOH大鼠LHb表達進一步升高;同時測量AMPAR受體亞基組分的mRNA水平,得到 GluA1 增多、 GluA2 減少, GluA1/GluA2 比值增高,提示神經元內鈣訊號傳導增強;western blotting結果顯示Post-EtOH大鼠LHb內的βCaMKII-AMPAR訊號分子表達增強,GluA1亞基ser831位元點發生磷酸化調控。內源性免疫共沈澱技術,發現LPA1與p-GluA1ser831存在相互作用,但LPA3未與p-GluA1ser831發生互作,提示在LHb內LPA1受體與βCaMKII-AMPAR訊號間存在相互作用。 皮爾森相關性分析得到LPA1的表達與大鼠在高架十字迷宮EPM測試中進入開放臂的次數呈顯著負相關,PKC-γ的表達與大鼠在基線期的酒精攝入呈顯著正相關;提示LPA1和PKC-γ在AUD共病負性情緒中的重要地位 。
最後,采用腦立體定位手術,LHb原位微註射LPA-LPA1/3受體拮抗劑或PKC-γ抑制劑,均能下調PKC-γ、βCaMKII、AMPAR訊號分子的表達水平,減少酒精大鼠的負性情緒行為和神經元的興奮性,降低酒精消耗量。LHb原位註射外源性18:1 LPA可以啟用LPA-LPA1/3受體,上調PKC-γ、βCaMKII、AMPAR訊號分子的表達水平,增強神經元的興奮性,誘導Naive大鼠產生AUD共病負性情緒表型。但是外源性LPA不能加重Post-EtOH大鼠的負性情緒及酒精消耗量。
總之,LHb內「LPA-LPA1-PKC-γ/βCaMKII-AMPAR-GluA1ser831磷酸化-神經元興奮性增強」訊號分子機制,在AUD共病負性情緒發病機制中和病理行程中有著重要的作用; LPA1和PKC-γ可作為防治AUD共病負性情緒疾病的分子靶標 。











