这篇回答,没有方法技巧!没有高考题!没有易错点!没有考向预测!
只有最最最最最基础的高考化学知识。化学基础差的同学看这里就够了!
基础知识+回归课本
基础知识包括:
1、常见物质俗名 2、常见物质颜色 3、常见实验现象
4、考试中经常用到的规律 5、「10电子」、「18电子」的微粒小结
6、具有漂白作用的物质 7、各种「气」汇集
8、滴加顺序不同,现象不同的实验 9、原电池 10、等效平衡问题及解题思路
11、常见物质分离提纯的10种方法 12、常用的去除杂质的方法10种
13、化学实验基本操作中的「不」15例
14、中学化学中与「0」有关的实验问题4例 15、特殊试剂的存放和取用10例
16、能够做喷泉实验的气体 16、最最基础的化学方程66个
回归课本包括:
必修1化学反应和化学方程式
必修2常见物质的颜色、物质的俗名和化学式
选修3 物质结构与性质(含必修1部分内容)
选修4 化学反应原理
选修5 有机化学基础
考点归纳
——————我是分割线——————
基础知识
1、常见物质俗名
无机部分:
纯碱、苏打、天然碱 、口碱:Na2CO3 小苏打:NaHCO3 大苏打:Na2S2O3
石膏(生石膏):CaSO4.2pO 熟石膏:2CaSO4·.pO 莹石:CaF2
重晶石:BaSO4(无毒) 碳铵:NpHCO3 石灰石、大理石:CaCO3
生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7pO (缓泻剂)
烧碱、火碱、苛性钠:NaOH 绿矾:FeSO4·7pO 干冰:CO2 明矾:KAl (SO4)2·12pO
漂白粉:Ca (ClO)2 、CaCl2(混和物) 泻盐:MgSO4·7pO 胆矾、蓝矾:CuSO4·5pO
双氧水:pO2 皓矾:ZnSO4·7pO 硅石、石英:SiO2 刚玉:Al2O3
水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4
黄铁矿、硫铁矿:FeS2 铜绿、孔雀石:Cu2 (OH)2CO3 菱铁矿:FeCO3 赤铜矿:Cu2O
波尔多液:Ca (OH)2和CuSO4 石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
过磷酸钙(主要成分):Ca (pPO4)2和CaSO4 重过磷酸钙(主要成分):Ca (pPO4)2 天然气、沼气、坑气(主要成分):Cp 水煤气:CO和p
光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。 尿素:CO(Np) 2
有机部分:
氯仿:CHCl3 电石:CaC2 电石气:C2p (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2pOH
氟氯烃:是良好的制冷剂,有毒,但破坏O3层。 醋酸:冰醋酸、食醋 CpCOOH
裂解气成分(石油裂化):烯烃、烷烃、炔烃、pS、CO2、CO等。 甘油、丙三醇 :C3H8O3
焦炉气成分(煤干馏):p、Cp、乙烯、CO等。 石炭酸:苯酚 蚁醛:甲醛 HCHO
福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸 HCOOH
葡萄糖:C6p2O6 果糖:C6p2O6 蔗糖:C12p2O11 麦芽糖:C12p2O11 淀粉:(C6p0O5)n
硬脂酸:C17p5COOH 油酸:C17p3COOH 软脂酸:C15p1COOH
草酸:乙二酸 HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。
2、常见物质颜色
铁:铁粉是黑色的;一整块的固体铁是银白色的。 Fe2+——浅绿色 Fe3O4——黑色晶体
Fe(OH)2——白色沉淀 Fe3+——黄色 Fe (OH)3——红褐色沉淀 Fe (SCN)3——血红色溶液
FeO——黑色的粉末 Fe (Np)2(SO4)2——淡蓝绿色 Fe2O3——红棕色粉末 FeS——黑色固体
铜:单质是紫红色 Cu2+——蓝色 CuO——黑色 Cu2O——红色 CuSO4(无水)—白色 CuSO4·5pO——蓝色 Cu2 (OH)2CO3 —绿色 Cu(OH)2——蓝色 [Cu(Np)4]SO4——深蓝色溶液
BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沉淀
Al(OH)3 白色絮状沉淀 pSiO4(原硅酸)白色胶状沉淀
Cl2、氯水——黄绿色 F2——淡黄绿色气体 Br2——深红棕色液体 I2——紫黑色固体
HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾
CCl4——无色的液体,密度大于水,与水不互溶 KMnO4--——紫色 MnO4-——紫色
Na2O2—淡黄色固体 Ag3PO4—黄色沉淀 S—黄色固体 AgBr—浅黄色沉淀
AgI—黄色沉淀 O3—淡蓝色气体 SO2—无色,有剌激性气味、有毒的气体
SO3—无色固体(沸点44.8 0C) 品红溶液——红色 氢氟酸:HF——腐蚀玻璃
N2O4、NO——无色气体 NO2——红棕色气体 Np——无色、有剌激性气味气体














——————分割线我又来了——————
回归课本
必修一
1. P4 常见危险化学品的标志,主要知道常见物质的性质与标志相对应。
如酒精为易燃液体、高锰酸钾为氧化剂、浓硫酸为腐蚀品、KCN为剧毒品。如P10习题第二题选B。
2. P6-7 熟记过滤、蒸发、蒸馏装置图,分别需要哪些仪器?
蒸馏烧瓶中温度计水银球的位置,冷凝管水流方向(若冷凝管竖直冷凝水流方向)。蒸馏烧瓶和普通烧瓶的区别。
3. P7 除去粗盐中的Ca2+、Mg2+、SO42-等杂质,先加入过量的BaCl2,至沉淀不再产生后,再加入过量的Na2CO3、NaOH,充分反应后将沉淀一并滤去,经检测发现滤液中仍含有一定量的SO42-,其原因是BaSO4和BaCO3的Ksp差不大,当溶液中存在大量的CO32-时,BaSO4就会部分转化为BaCO3。其中Na2CO3的作用是:除Ca2+和过量的Ba2+。所以试剂加入顺序Na2CO3在之BaCl2后。
4. P9 萃取和分液:
分液装置图,分液漏斗的结构(两活塞、两小孔)。溴水呈橙色、溴的(苯)CCl4橙红色。碘水呈黄色,碘的(苯)CCl4呈紫红色。萃取后分液,上下层液体分别从上下口倒出。注意实验1-4的第(2)步、(4)步操
作的注意事项及规范的文字表述。P9关于CCl4的注解①
5.P10 第6-7题
氯离子、CO32-和SO42-的检验方法。
6.P16 配制一定物质的量浓度的溶液()
重点注意步骤、图示、注解、注意事项(包括P18习题6)、学与问等。称量固体时托盘天平只保留一位,量筒量取液体时也只保留一位。
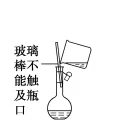
容量瓶使用的第一步操作:检查是否漏水(简称「查漏」)。「查漏」的方法:向容量瓶中加入适量水,盖好瓶塞,左手食指顶住瓶塞,右手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将容量瓶正立,将瓶塞旋转180度,重复上述操作,如果瓶口处仍无水渗出,则此容量瓶不漏水。若漏水,可以在瓶塞处涂凡士林。常见容量瓶的规格有50 mL、100 mL、250 mL、500 mL、1000 mL 几种。如配制溶液时明确知道所需容量瓶规格,则需将容量瓶规格一并答上。如图所示:用玻璃棒引流时,玻璃棒末端应插入到刻度线以下,且玻璃棒靠近容量瓶口处且不能接触瓶口。定容时,胶头滴管不能伸入容量瓶。配制一定物质的量浓度的溶液所需要的实验仪器:托盘天平、量筒、玻璃棒、容量瓶(容量一定要指明)、胶头滴管、烧杯、药匙。重要的实验步骤:计算→称量(量取)→溶解(稀释)→转移(轻摇)→定容→摇匀→倒出装瓶。定容时视线与凹液面最低处相平,直到液面与刻度线相切。
7. P26-27
认真阅读科学探求、科学史话、胶体的定义、胶体的性质、Fe(OH)3胶体制备 、区别胶体和溶液的方法等知识:FeCl3溶液呈棕黄色,制备Fe(OH)3胶体的操作方法是:在沸水中滴加饱和FeCl3溶液,继续煮沸至红褐色,停止加热。将0.1mol FeCl3制成胶体,所得的胶粒数小于0.1NA,Fe(OH)3胶体不带电,Fe(OH)3胶粒带正电。 FeCl3溶液和Fe(OH)3胶体最本质的区别是胶体粒子大小在1nm-100nm之间,区别
我承认我懒了,直接放图













以上这些吃透,你的基础要是还差,我把它们打印出来全吃了












