
前 言
題主的問題是一個看似簡單,實際相當復雜的問題、又非常有趣的問題。
這個問題的實質是:為什麽人體在能量不足的狀態下,不用分解脂肪的能量來增肌。
我大致看了下所有的答案,大多數都不靠譜,方向也不正確。
有幾個稍微靠譜點的答案提出「蛋白質也會參與分解供能」的說法,雖然不能說是完全錯,但也過於粗淺,也不觸及問題的本質。
要把這個問題說清楚,必須涉及一些生物學基礎知識,這可能對於一般的健身愛好者來說有點偏深了。但是這些內容,也是基礎知識,對大家有好處。
一、既然談到了掉肌肉,就得說說肌肉
人體的肌纖維,大致是下面這樣的樣子。
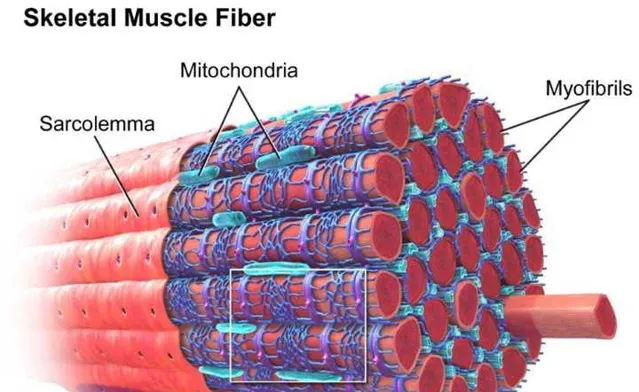
肌纖維中,有一些更細的結構,叫肌原纖維,也就是圖中右上角的myofibrils,肌原纖維 的內部 是肌蛋白[35,36]。
愛好者們經常說,你增肌了,或者你肌肉圍度掉了,其實這就是因為 肌原纖維中的蛋白質 增加了[37]、或者減少了[75]。
當然,肌原纖維中的蛋白質有很多種[76,77],本文不詳細介紹,就用一個「肌蛋白」來統稱。
二、作為常識,人的肌肉中的蛋白質是一邊合成一邊分解的,處於動態平衡中
人活著,有生命。
生命的基本特征是新陳代謝[78]。
新陳代謝的重要特征之一,就是不斷更新組織:
舊的組織不斷死亡(被分解)[79],新的組織不斷產生(被合成)。
在我們的肌肉中也是一樣,肌肉大小取決於肌肉中的蛋白質分解和合成的差值[1]。
在常態下,它們不斷被分解、不斷被合成,維持平衡,我們的肌肉大小就不變。
合成>分解=正平衡=增肌=肌纖維變粗
分解>合成=負平衡=減肌=肌纖維變細

在訓練的刺激下,平衡被打破,合成大於增長[2,98,99],就體現為增肌了。
但是,能刺激肌肉合成的刺激源,不光有訓練。
我前不久才寫的文章中列舉了8大量證據表明,攝入蛋白質,也是一種增肌的刺激源。
不健身直接吃蛋白粉會怎麽樣?
三、肌肉(肌蛋白)是如何合成的?
以DNA為開端,制造出來的。
怎麽制造呢?主要步驟兩步。
步驟一:DNA轉錄
大家都知道,DNA是雙螺旋結構的。
在轉錄過程中,它以自身為藍本,復制出自身的單螺旋結構:mRNA[80]。
mRNA是在細胞核 內 產生的,會從核上的孔出去,進入細胞質。

步驟二:mRNA轉譯

在細胞質中,mRNA作為樣版,接受身體(實際上是tRNA)運來的胺基酸[81]。
這些胺基酸能辨識mRNA上的特定辨識區,從而精準的對號入座,組裝成蛋白質的雛形。
下面是個示意圖,真實的蛋白質具有更復雜的空間結構。

然後,還要經過折疊、加工、運載、修飾,才成為我們的肌蛋白[82]。
所以:肌肉中的蛋白質是怎麽來的?
用DNA作為合成的起點,給造出來的。
四、DNA為什麽會開始轉錄呢?

答案是,有什麽東西(刺激源)刺激了它。
常見的刺激源包括:
1、訓練[68,69,70]
2、營養[40,41,47,48,49,50,51,66,67]
3、激素[42,43,44,45,46]
所以我們說,訓練也好,營養也好,激素也好,性質是一樣的:
都是透過刺激DNA的表達,來得到更多的肌肉(肌蛋白)。

這就解釋了為什麽,健美圈子的人都說「不行的人,給他一噸藥他也不行」;
這就解釋了為什麽,有些狂熱的愛好者甚至會超過冠軍們的劑量,但是他們成不了冠軍。
這其中的原因,就在於DNA。
藥物和訓練還有營養,都透過刺激DNA(的表達)來生效;
它們只是刺激源,DNA對刺激的反應才是關鍵。
面對同樣強度的刺激,不同的人的DNA產生的反應截然不同;
經歷了同樣的訓練,有些人的增肌效果是另外一些人的幾倍甚至十幾倍之多。
五、這些刺激源,是如何刺激DNA轉錄的?
1、以訓練為例:
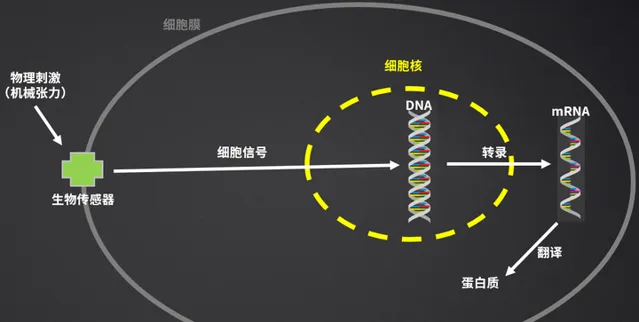
(1)訓練的物理刺激(機械刺激),透過生物傳感器;
(2)生物傳感器們,將這些刺激轉化為細胞內的資訊號;
(3)這些訊號最終傳遞到DNA上,引起了DNA的轉錄;
(4)然後mRNA轉譯為蛋白質。
所以,我們說,訓練實際上是在刺激DNA,因為DNA才是生命活動的中心。
2、生物傳感有哪些呢?
(1)肋節(Costameres)

肋節(Costamere)能將肌細胞膜與肌原纖維、細胞外基質、還有肌纖維上特點的點位(肌節)連線起來[3],加強肌細胞膜的穩定性和強度[4],在一定程度上保護它們免收外力損傷[5]。
肋節能感受、偵測到施加於及細胞的外力(例如我們所說的機械張力),將其傳導到肌細胞內部,轉化為生物訊號[6,7]。
(2)71整合素(α7β1-integrin)
71整合素是一種橫跨細胞膜的受體,它富含於骨骼肌中,它在基膜和肋節(Costamere)中的一些蛋白間,提供一種連線作用[8]。
一方面,它增加肌細胞與細胞外基質的 「粘附」 ,增加細胞的穩定性;另一方面,它能將機械(訓練外力)和化學資訊從細胞外傳遞到細胞內,它在機械刺激(訓練)轉化為生物訊號傳遞過程中,發揮了重要作用[9,10]。
還有磷脂酸(PA)、FAK—粘著斑激酶等也參與機械張力轉化為細胞訊號的傳導傳導,就不多說了。

六、從生物傳感器到DNA之間的訊號
從跨膜或細胞膜外的生物傳感器到DNA之間,還有很長一段路要走。
我們在本文大致簡介最基礎、最重要、最著名的路徑之一:
PI3K-Akt-mTOR途徑 [38,39,71,72,73]。

如圖所示,在這條通路中,一般首先啟用PI3K,然後是Akt,然後是mTOR[52,53,54,55,56]。
在mTOR的下遊,有2個因子,分別是S6K(S6激酶)[57,58,59]和4E(真核生物起始因子4E)[60,61]。
S6K和4E能啟用DNA轉錄(圖中紅色方框),從而引發蛋白質合成[62,63,64,65]。
這其中的重點,是mTOR 。
mTOR是我們細胞內的一種蛋白,全稱是「哺乳動物雷帕黴素靶蛋白」。
它由2549個胺基酸組成的大蛋白,預測它的分子量是28.9萬道爾頓[11]。
但是,尺寸排除色譜法(SEC)顯示它的分子量為1-2百萬道爾頓[12],這說明它實際上存在於一些大得多的蛋白復合物中。
進一步的分析表明,mTOR實際上以 mTORC1 (復合物1)和 mTORC2 (復合物2)的形式在我們體記憶體在。

mTORC1下遊有2個因子:
S6激酶(p70S6K)和真核生物起始因子4E(4EBP-1),圖中倒數第二行的小紅圈。

在這張圖上,大家可以看到,最大的紅圈就是mTOR的大型復合物mTORC1;
它的下遊有2個靶點,左邊的小紅圈是S6K(S6激酶),右邊的小紅圈是4E-BP(真核生物起始因子4E-結合蛋白)。
在這張圖上,還有個紅色方框,轉譯過來就是轉錄(DNA轉錄)。
七、mTORC1與轉錄起始因子
1、mTORC1可以啟用它的下遊因子。
1999年,Baar等人發現大鼠的抗阻訓練可以啟用它們的S6激酶,並造成增肌[26]。怎麽啟用S6激酶的呢?
訓練的物理刺激(機械張力)可以啟用 mTORC1 [13,14,15,16,17,18],然後啟用其下遊的S6激酶。
所以S6激酶是mTORC1的下遊因子。
2、怎麽啟用呢?
透過「磷酸化」[96]。
磷酸化是一個生化術語,是自然界一種非常普遍的、對蛋白質進行 化學修飾 的過程。
在磷酸激酶的作用下,生物將磷酸基團加在 蛋白質或蛋白類中間產物 上,從而將蛋白質磷酸化(或者去磷酸化)。
經化學修飾後的蛋白質,功能/生物活性會顯著不同。
S6激酶是重要的DNA轉錄起始因子[19]。
它被啟用後,接下來核糖體蛋白6被磷酸化,從而增加了核糖體蛋白與5‘端寡核苷酸(5’-top)mRNA的親和力,引起了DNA轉錄[90,91,92];
而蛋白質不足則可以導致核糖體蛋白6的去磷酸化[92]。
3、mTORC1的下遊因子不止一個
大家在圖9和圖11中看到,mTORC1的下遊,除了S6激酶外,還有一個4E-BP。
4E,指的是真核生物起始因子4E[20,21]。
圖上寫的是4E-BP,它是4E-結合蛋白的縮寫,這種蛋白「包裹」著4E,讓它平時處於「不可用」狀態,不發揮作用,就有點像粽子外麵包裹的葉子一樣。
磷酸化4E-BP後,就像撥開了粽子的葉子,粽子(4E)就暴露出來了。
接下來,4E與mRNA上的5′端帽結構交互作用,激發轉錄[22,23]。
也就是說,機械張力啟用了mTORC1後,也導致了它的下遊因子S6和4E-BP被磷酸化,然後引發了DNA的轉錄,然後我們得到了更多肌蛋白。
如果我們用上面的內容,把圖7中的細胞訊號替換掉的話,就是這樣的概念:

不出意外,Dreyer等人發現,如果抑制mTOR訊號,則會抑制肌肉蛋白質合成[74]。
所以,mTORC1的啟用、S6相關蛋白的磷酸化,對於肌肉合成來說,來說非常重要[87]。
Ger等人的研究發現,S6磷酸化水平與1RM深蹲成績、整體去脂體重、腿部瘦體重、IIA型肌纖維橫截面積等,都存在 極強的正相關性 。

八、mTOR受細胞能量水平影響
我們離題主的問題的答案,已經越來越近了。
mTOR作為調節細胞分裂、生長、細胞尺寸的重要途徑,它具有「 能量敏感性 」。
Dennis等人證實 mTOR訊號通路受細胞內ATP濃度的影響 [34]。
那麽,mTOR訊號通路是如何被細胞能量水平影響的?
大家應該還記得:
1、人類的細胞自能使用ATP系統作為直接能量來源;
2、其他能量系統(CP、無氧糖解作用、有氧氧化系統等)都只能為ATP充能。
3、如果把ATP比喻為是充滿了能量的電池,那AMP就是空電池。

所以,空電池與滿電池的比值(AMP/ATP)的比值,就反映了細胞能量水平。
當細胞能量水平較低時,AMP多,ATP少。

此時,人體會啟用一種激酶: AMP活化蛋白激酶 ,這是人體 感知能量水平的機制 [95,96]。
這是AMP活化蛋白激酶的立體結構。
AMP活化蛋白激酶被啟用後,它會抑制增肌所需的mTORC通路[89],如下圖所示。

這個邏輯在生物學角度來說,也完全合情合理:
因為mTORC1驅動細胞生長、分化、增殖的過程,而這些行為會消耗大量的細胞能量。
如果人體面臨總體上的能量不足,就必須把能量用於維持生命(心臟、腦等),而不能用於其它事情。
九、題主的問題,答案出來了
答案就是,細胞能量水平低,會啟用AMP活化蛋白激酶,從而抑制mTOR,抑制肌蛋白DNA的轉錄/轉譯。
這就解釋了為什麽有氧運動會抵消、減少力量訓練帶來的肌肉增長。
因為有氧耐力運動,會大量消耗ATP,從而產生更多的AMP,啟用AMP活化蛋白激酶。
這也解釋了為什麽有氧運動前、中、後持續補糖,有利於肌肉的留存。
現在我們倒回來看題主的問題:人能不能大量分解自身脂肪,用這些能量來合成肌肉?
答案是不能,或者非常難。
因為人要大量分解自身脂肪,有個前提:能量不足。
例如在血糖/肝糖較低時候,身體分泌更多的胰高血糖素、皮質醇等,加速對脂肪的分解。
在這種情況下,mTOR訊號通路被抑制,它下遊的S6激酶、S6核糖蛋白、真核生物起始因子4E等被 去磷酸化 。
因此我們很難增肌,肌肉合成會小於分解,出現肌肉的「負平衡」。
這就是為什麽人體很難動用自身脂肪來增肌。
這就是為什麽,增肌和減脂之間存在明顯的矛盾。
那為什麽新手可以增肌同時減脂呢?
我們在前面已經提到了Atk、S6K(S6激酶)、rpS6(S6核糖蛋白)在mTOR訊號通路中的啟用,表現為 磷酸化 。
數據告訴我們,新手和老手接受訓練後,mTOR通路中的磷酸化水平不一樣。
(1)對人類的實驗發現,2個多月訓練後,新手的Akt、S6K的 磷酸化持續時間 比老手要長;
(2)另一項研究發現,職業舉重運動員進行訓練後,他們的S6K、rpS6磷酸化沒有增加——但與之形成鮮明對比的是,未經訓練的人的相應蛋白,則在訓練後的發生了明顯的磷酸化。
這些數據解釋了:
——因為mTOR路徑上相應蛋白(酶)的磷酸化程度存在差異。
本文結束,感謝閱讀
這如果覺得好,不希望傳播知識的文章埋沒在行銷廣告中,請點贊、轉發、留言。
你們的支持會是我繼續輸出內容的動力,感謝大家!
擴充套件閱讀
肉崽:力訓研究所課程介紹
肉崽:力訓研究所線上期刊介紹
健身5/6分化訓練根本不適合普通人
肉崽:力訓研究所新手指南(十二)為什麽分化訓練不適合普通人(上)
肉崽:力訓研究所新手指南(十三)為什麽分化訓練不適合普通人(中)
肉崽:力訓研究所新手指南(十四)為什麽分化訓練不適合普通人(下)
新手臥推用手臂?老手才能用胸發力?臥推要感受胸肌才有效?假的
肉崽:臥推不需要感受胸肌或專註於胸肌收縮
怎麽找到啞鈴劃船背闊肌發力感?
練胸肌的時候,手臂力量經常跟不上怎麽辦?
訓練後不拉伸,沒有任何問題
肉崽:訓練後需要拉伸嗎?(一)
肉崽:訓練後需要拉伸嗎?(二)
肉崽:訓練後需要拉伸嗎?(三)
肉崽:訓練後需要拉伸嗎:參考文獻(1-200)
肉崽:訓練後需要拉伸嗎:參考文獻(200-323)
健美訓練中被人誤解的幾大要素
肉崽:被誤解最多的健美訓練要素(一):輕重量精確刺激肌肉
肉崽:被誤解最多的健美訓練要素(二):慢速動作
肉崽:被誤解最多的健美訓練要素(三):孤立訓練
肉崽:被誤解最多的健美訓練要素(四):變換動作給予肌肉新刺激
肉崽:被誤解最多的健美訓練要素(五):依據肌纖維型別針對訓練
肉崽:「8-12次最佳增肌次數範圍」 其實是個偽命題
動作細節=技術?細節不同天翻地覆?純屬瞎掰。
肉崽:動作細節的影響有多大?
飛鳥和夾胸練中縫,純屬虛構
肉崽:胸肌中縫和鎧甲胸是飛鳥練出來的嗎?
練胸不練背,既不會改變體態,也不會「圓肩」
肉崽:練胸不練背會圓肩?有多少人上當受騙?
並不是訓練讓我們變強,而是訓練激發了、挖掘了你本身就有的潛力。
那些健身模特是不是都在用類固醇?普通人能不能練成這樣?
訓練增肌的核心原理,並不是「練得微損傷後修復增粗」
肉崽:力訓研究所新手指南(八)增肌的深層原理
激素的增肌原理,其實跟訓練是一樣的
既然只有蛋白質才能轉化肌肉為什麽增肌期間還要攝入大量碳水?
生長激素到底能夠增加肌纖維數量嗎?
營養具有跟訓練、激素類似的增肌作用
為什麽減脂容易掉肌肉?
不健身直接吃蛋白粉會怎麽樣?
健身練到那種程度可以開始喝蛋白粉?
人人都在說蛋白質過量,但其實很難實作
蛋白質攝入過多的危害有哪些?
健身一定要喝蛋白粉嗎,還有健身危害比如說對肝臟?
肉崽:聊聊補劑商人自己都不知道的左旋肉堿用處
高訓練量是個坑,而且是大坑
肉崽:堆訓練量?3倍努力,事倍功半
肉崽:從一個高容量計劃換成另一個高容量計劃,為什麽進步了?
肉崽:10X10改良版數據帶給我們的啟示
同樣的訓練,有些人比別人增肌振幅大好幾倍,不是因為技術差異
肉崽:訓練潛力與遺傳(一):蛋白質與基因
肉崽:訓練潛力與遺傳(二):DNA的表達
肉崽:訓練潛力與遺傳(三):肌肉水平與細胞核
肉崽:訓練潛力與遺傳(四):肌肉水平與微RNA
肉崽:訓練潛力與遺傳(五):肌肉增長與睪酮受體
對於同一個訓練體系來說,肌肉和力量成正比
肉崽:力量舉的「天賦」主要指什麽?
睡眠從分子角度如何影響肌肉的代謝
「肌肉在休息的時候超量生長」,其中關於「休息」的定義是睡覺嗎?
如果你每天睡眠時間只有6個小時,你是否願意拿出半個小時鍛煉身體?
為何一天1小時的力量+高強度無氧+1小時有氧跑,已堅持近半個月既沒減脂又沒增肌?
肉崽:健身與睡眠(三)
生酮飲食的效果與高碳飲食的減肥效果差異很小
肉崽:生酮飲食(一):效果
肉崽:低碳生酮飲食(五)副作用:概況和死亡風險
肉崽:低碳生酮飲食(七)副作用:肝損傷
肉崽:低碳生酮飲食(八)副作用:骨健康
肉崽:低碳生酮飲食(九)副作用:骨健康
肉崽:低碳生酮飲食(十一)腎結石和膽結石
肉崽:生酮飲食是如何損害心臟的?(上)
肉崽:生酮飲食是如何損害心臟的?(下)
個人實踐沒有任何說服力,「幹就完了」「練得大說得對」都屬於缺乏基本的邏輯和常識
肉崽:健身愛好者最大的誤區之一:「實踐出真知」
肉崽:力咖新手指南(六)新手必須避開的認知雷區:(上)
肉崽:力咖新手指南(六)新手必須避開的認知雷區:(中)
營養/恢復相關
健身一年沒有什麽進步,正常嗎?
為什麽減脂容易掉肌肉?
既然只有蛋白質才能轉化肌肉為什麽增肌期間還要攝入大量碳水?
為何一天1小時的力量+高強度無氧+1小時有氧跑,已堅持近半個月既沒減脂又沒增肌?
為什麽都說增肌要碳水?
當代年輕人為什麽尿酸會高?
肌酸跟蛋白粉到底對腎臟有沒有影響?
References
1. Atherton PJ, Phillips BE, Wilkinson DJ.Exercise and Regulation of Protein Metabolism. Prog Mol Biol Transl Sci . 2015;135:75–98.
2. Phillips SM, Tipton KD, Aarsland A, Wolf SE, Wolfe RR.Mixed muscle protein synthesis and breakdown after resistance exercise in humans. The American journal of physiology . 1997;273(1 Pt 1):E99–107.
3. Luisa Gorza; Matteo Sorge; Laura Seclì; Mara Brancaccio.Master Regulators of Muscle Atrophy: Role of Costamere Components.Cells 2021, 10(1), 61.
4. Ervasti JM, Ohlendieck K, Kahl SD, Gaver MG, Campbell KP. Deficiency of a glycoprotein component of the dystrophin complex in dystrophic muscle. Nature 1990;345:315–9.
5. Clark KA, McElhinny AS, Beckerle MC, Gregorio CC. Striated muscle cytoarchitecture: an intricate web of form and function. Annu Rev Cell Dev Biol 2002;18:637–706.
6. Judice CC, Marin TM, Franchini KG. Calcium and the mechanotransduction in cardiac myocytes. Front Biosci (Elite Ed) 2009;1:189–99.
7. Samarel AM. Costameres, focal adhesions, and cardiomyocyte mechanotransduction. Am J Physiol Heart Circ Physiol 2005;289:p291–301.
8. Berthier C, Blaineau S. Supramolecular organization of the subsarcolemmal cytoskeleton of adult skeletal muscle fibers. A review. Biol Cell 89: 413–434, 1997.
9. Di Mauro D, Gaeta R, Arco A, Miliardi D, Lentini S, Runci M, et al. Distribution of costameric proteins in normal human ventricular and atrial cardiac muscle. Folia Histochem Cytobiol 2009;47(4):605–8.
10. Vatta M, Sinagra G, Brunelli L, Faulkner G. Remodeling of dystrophin and sarcomeric Z-band occurs in pediatric cardiomyopathies: a unifying mechanism for force transmission defect. J Cardiovasc Med (Hagerstown) 2009;10(2):149–56.
11. Sabers CJ, Martin MM, Brunn GJ et al.Isolation of a Protein Target of the FKBP12-Rapamycin Complex in Mammalian Cells. The Journal of biological chemistry . 1995;270(2):815–22.
12. Kim D-H, Sarbassov DD, Ali SM et al.mTOR Interacts with Raptor to Form a Nutrient-Sensitive Complex that Signals to the Cell Growth Machinery. Cell . 2002;110(2):163–75.
13. Bodine SC, Stitt TN, Gonzalez M, Kline WO, Stover GL, Bauerlein R, Zlotchenko E, Scrimgeour A, Lawrence JC, Glass DJ, Yancopoulos GD. Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo. Nat Cell Biol 3: 1014 – 1019, 2001.
14. Goodman CA, Miu MH, Frey JW, Mabrey DM, Lincoln HC, Ge Y, Chen J, Hornberger TA. A phosphatidylinositol 3-kinase/protein kinase B-independent activation of mammalian target of rapamycin signaling is sufficient to induce skeletal muscle hypertrophy. Mol Biol Cell 21: 3258 –3268, 2010.
15. Hornberger TA, McLoughlin TJ, Leszczynski JK, Armstrong DD, Jameson RR, Bowen PE, Hwang ES, Hou H, Moustafa ME, Carlson BA, Hatfield DL, Diamond AM, Esser KA. Selenoprotein-deficient transgenic mice exhibit enhanced exercise-induced muscle growth. J Nutr 133: 3091–3097, 2003.
16. Hornberger TA, Stuppard R, Conley KE, Fedele MJ, Fiorotto ML, Chin ER, Esser KA. Mechanical stimuli regulate rapamycin-sensitive signaling by a phosphoinositide 3-kinase-, protein kinase B- and growth factor-independent mechanism. Biochem J 380: 795–804, 2004.
17. Kubica N, Bolster DR, Farrell PA, Kimball SR, Jefferson LS. Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2Bepsilon mRNA in a mammalian target of rapamycin-dependent manner. J Biol Chem 280: 7570 –7580, 2005.
18. Miyazaki M, McCarthy JJ, Fedele MJ, Esser KA. Early activation of mTORC1 signalling in response to mechanical overload is independent of phosphoinositide 3-kinase/Akt signalling. J Physiol 589.7: 1831–1846, 2011.
19. Satoshi Fujita, Hans C Dreyer, Micah J Drummond, Erin L Glynn, Jerson G Cadenas, Fumiaki Yoshizawa, Elena Volpi, Blake B Rasmussen.Nutrient signalling in the regulation of human muscle protein synthesis.J Physiol. 2007 Jul 15;582(Pt 2):813-23.
20. Kimball SR, Jefferson LS, Fadden P, Haystead TAJ, Lawrence JC 1996 Insulin and diabetes cause reciprocal changes in the association of eIF-4E and PHAS-I in rat skeletal muscle. Am J Physiol 270:C705–C709.
21. Pause A, Belsham G, Gingras AC, Donze O, Lin TA, Lawrence JC, Sonenberg N 1994 Insulin-dependent stimulation of protein synthesis by phosphorylation of a regulator of 5-cap function. Nature 371:762–767.
22 Higbie EJ, Cureton KJ, Warren GL 3rd, Prior BM. Effects of concentric and eccentric training on muscle strength, cross-pal area, and neural activation. J Appl Physiol 81: 2173–2181, 1996.
23. Hornberger TA, Armstrong DD, Koh TJ, Burkholder TJ, Esser KA. Intracellular signaling specificity in response to uniaxial vs. multiaxial stretch: implications for mechanotransduction. Am J Physiol Cell Physiol 288: C185–C194, 2005.
24. Zanchi NE, Lancha Jr AH. Mechanical stimuli of skeletal muscle: implications on mTOR/p70s6k and protein synthesis. Eur J Appl Physiol 2008;102:253–63.
25. Klossner S, Durieux AC, Freyssenet D, Flueck M. Mechano-transduction to muscle protein synthesis is modulated by FAK. Eur J Appl Physiol 2009;106:389– 98.
26. Baar K, Esser K.Phosphorylation of p70(S6k) correlates with increased skeletal muscle mass following resistance exercise. The American journal of physiology . 1999;276(1 Pt 1):C120–7.
27. Oldham, S., J. Montagne, T. Radimerski, G. Thomas, and E. Hafen.2000. Genetic and biochemical characterization of dTOR, the Drosophila homolog of the target of rapamycin.Genes Dev.14:2689-2694.
28. Zhang, H., J. P. Stallock, J. C. Ng, C. Reinhard, and T. P. Neufeld.2000. Regulation of cellular growth by the Drosophila target of rapamycin dTOR.Genes Dev.14:2712-2724.
29. Fingar, D. C., S. Salama, C. Tsou, E. Harlow, and J. Blenis.2002. Mammalian cell size is controlled by mTOR and its downstream targets S6K1 and 4EBP1/eIF4E.Genes Dev.16:1472-1487.
30. Montagne J, Stewart MJ, Stocker H, Hafen E, Kozma SC, Thomas G. Drosophila S6 kinase: A regulator of cell size. Science. 1999;285:2126–2129.
31. Oldham S, Montagne J, Radimerski T, Thomas G, Hafen E. Genetic and biochemical characterization of dTOR, the Drosophila homolog of the target of rapamycin. Genes & Dev. 2000;14:2689–2694.
32. Zhang H, Stallock JP, Ng JC, Reinhard C, Neufeld TP. Regulation of cellular growth by the Drosophila target of rapamycin dTOR. Genes & Dev. 2000;14:2712–2724.
33. Miron M, Verdu J, Lachance PE, Birnbaum MJ, Lasko PF, Sonenberg N. The translational inhibitor 4E-BP is an effector of PI(3)K/Akt signalling and cell growth in Drosophila.Nat Cell Biol. 2001; 3 :596–601.
34. Diane C Fingar, John Blenis.Target of rapamycin (TOR): an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression.Oncogene
. 2004 Apr 19;23(18):3151-71.
35. N Narayanan, J Eapen.Protein synthesis by rat cardiac muscle myofibrils.Biochim Biophys Acta. 1973 Jun 23;312(2):413-25.
36. Kono,Fumiaki,Shimamoto,Yuta,Ishiwata,Shin'ichi.1P246 Effect of lattice spacing on SPOC of skeletal myofibrils(8. Muscle contraction and muscle protein,Poster Session,Abstract,Meeting Program of EABS & BSJ 2006)
37. D L, Pak-Loduca, K A Obert, KE Yarasheski.Resistance exercise acutely increases MHC and mixed muscle protein synthesis rates in 78-84 and 23-32 yr olds.Am J Physiol Endocrinol Metab. 2000 Apr;278(4):E620-6.
38. Dreyer HC, Fugita S, Cadenas JG, Chinkes DL, Volpi E, Rasmussen B (2006) Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol 576:613–624
39. Kubica N, Bolster DR, Farrell PA, Kimball SR, JeVerson LS (2005) Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2B mRNA in a mammalian target of rapamycin-dependent manner. J Biol Chem 280:7570– 7580
40. S R Kimball.Regulation of translation initiation by amino acids in eukaryotic cells.Prog Mol Subcell Biol . 2001;26:155-84. doi: 10.1007/978-3-642-56688-2_6.
41. Karlsson HK, Nilsson PA, Nilsson J, Chibalin AV, Zierath JR, Blomstrand E (2004) Branched-chain amino acids increase p70S6k phosphorylation in human skeletal muscle after resistance exercise. Am J Physiol Endocrinol Metab 287:E1–E7
42. DeVol, D. L., Rotwein, P., Sadow, J. L., Novakofski, J., & Bechtel,P. J. (1990). Activation of insulin-like growth factor gene expression during work-induced skeletal muscle growth. Am. J.Physiol., 259, E89–E95.
43. Vandenburgh, H. H., Karlisch, P., Shansky, J., & Feldstein, R.(1991). Insulin and IGF-I induce pronounced hypertrophy of skeletal myofibers in tissue culture. Am. J. Physiol., 260, C475–C484.
44. Florini JR, Ewton DZ, Coolican SA. Growth hormone and the insulin-like growth factor system in myogenesis. Endocr Rev 17:481–517, 1996.
45.Rommel C., Bodine S.C., Clarke B.A., Rossman R., Nunez L., Stitt T.N., Yancopoulos G.D., Glass D.J. Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI(3)K/Akt/GSK3 pathways. Nat. Cell Biol. 2001;3:1009–1013.
46.Peng X.D., Xu P.Z., Chen M.L., Hahn-Windgassen A., Skeen J., Jacobs J., Sundararajan D., Chen W.S., Crawford S.E., Coleman K.G., et al. Dwarfism, impaired skin development, skeletal muscle atrophy, delayed bone development, and impeded adipogenesis in mice lacking Akt1 and Akt2. Genes Dev. 2003;17:1352–1365.
47. Douglas Paddon-Jones 1 , Melinda Sheffield-Moore, Xiao-Jun Zhang, Elena Volpi, Steven E Wolf, Asle Aarsland, Arny A Ferrando, Robert R Wolfe.Amino acid ingestion improves muscle protein synthesis in the young and elderly.Am J Physiol Endocrinol Metab. 2004 Mar;286(3):E321-8.
48. K Smith, J M Barua, P W Watt, C M Scrimgeour, M J Rennie.Flooding with L-[1-13C]leucine stimulates human muscle protein incorporation of continuously infused L-[1-13C]valine.Am J Physiol. 1992 Mar;262(3 Pt 1):E372-6.
49. Volpi E, Kobayashi H, Sheffield-Moore M, Mittendorfer B, Wolfe RR. Essential amino acids are primarily responsible for the amino acid stimulation of muscle protein anabolism in healthy elderly adults. Am J Clin Nutr. 2003;78:250–8.
50. P J Garlick, I Grant.Amino acid infusion increases the sensitivity of muscle protein synthesis in vivo to insulin. Effect of branched-chain amino acids.Biochem J. 1988 Sep 1;254(2):579-84.
51. Koopman R, Crombach N, Gijsen AP, et al. Ingestion of a protein hydrolysate is accompanied by an accelerated in vivo digestion and absorption rate when compared with its intact protein. Am. J. Clin. Nutr. 2009; 90:106Y15.
52. Rommel C., Bodine S.C., Clarke B.A., Rossman R., Nunez L., Stitt T.N., Yancopoulos G.D., Glass D.J. Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI(3)K/Akt/GSK3 pathways. Nat. Cell Biol. 2001;3:1009–1013.
53. Peng X.D., Xu P.Z., Chen M.L., Hahn-Windgassen A., Skeen J., Jacobs J., Sundararajan D., Chen W.S., Crawford S.E., Coleman K.G., et al. Dwarfism, impaired skin development, skeletal muscle atrophy, delayed bone development, and impeded adipogenesis in mice lacking Akt1 and Akt2. Genes Dev. 2003;17:1352–1365.
54. Bodine S.C., Latres E., Baumhueter S., Lai V.K., Nunez L., Clarke B.A., Poueymirou W.T., Panaro F.J., Na E., Dharmarajan K., et al. Identification of ubiquitin ligases required for skeletal muscle atrophy. Science. 2001;294:1704–1708.
55. Pallafacchina G., Calabria E., Serrano A.L., Kalhovde J.M., Schiaffino S. A protein kinase B-dependent and rapamycin-sensitive pathway controls skeletal muscle growth but not fiber type specification. Proc. Natl. Acad. Sci. USA. 2002;99:9213–9218.
56. Glass D.J. Molecular mechanisms modulating muscle mass. Trends Mol. Med. 2003;9:344–350.
57. Pallafacchina, G., Calabria, E., Serrano, A. L., Kalhovde, J. M.,& Schiaffino, S. (2002). A protein kinase B-dependent and rapamycin- sensitive pathway controls skeletal muscle growth but not fiber type specification. Proc. Natl. Acad. Sci. U.S.A.,25.
58. Inoki, K., Li, Y., Zhu, T., Wu, J., & Guan, K. L. (2002). TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling.Nat. Cell. Biol., 4, 648–657.
59. Hannan, K. M., Thomas, G., & Pearson, R. B. (2003). Activation of S6K1 (p70 ribosomal protein S6 kinase 1) requires an initial calcium-dependent priming event involving formation of a highmolecular-mass signalling complex. Biochem. J., 370, 469–477.
60. Kimball SR, Jefferson LS, Fadden P, Haystead TAJ, Lawrence JC 1996 Insulin and diabetes cause reciprocal changes in the association of eIF-4E and PHAS-I in rat skeletal muscle. Am J Physiol 270:C705–C709.
61. Pause A, Belsham G, Gingras AC, Donze O, Lin TA, Lawrence JC, Sonenberg N 1994 Insulin-dependent stimulation of protein synthesis by phosphorylation of a regulator of 5-cap function. Nature 371:762–767.
62.Gruner S., Peter D., Weber R., Wohlbold L., Chung M.Y., Weichenrieder O., Valkov E., Igreja C., Izaurralde E. The structures of eIF4E-eIF4G complexes reveal an extended interface to regulate translation initiation. Mol. Cell. 2016;64:467–479.
63. Kubica, N., Bolster, D. R., Farrell, P. A., Kimball, S. R., & Jefferson,L. S. (2005). Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2B{epsilon} mRNA in a mammalian target of rapamycin-dependent manner.J. Biol. Chem., 280, 7570–7580.
64. Proud CG, Denton RM 1997 Molecular mechanisms for the control of translation by insulin. Biochem J 328:329–341
65. Kleijn M, Scheper GC, Voorma HO, Thomas AA 1998 Regulation of translation initiation factors by signal transduction. Eur J Biochem 253:531–544.
66. Jeffery Escobar, Jason W Frank, Agus Suryawan, Hanh V Nguyen, Scot R Kimball, Leonard S Jefferson, Teresa A Davis.Regulation of cardiac and skeletal muscle protein synthesis by individual branched-chain amino acids in neonatal pigs.Am J Physiol Endocrinol Metab. 2006 Apr;290(4):E612-21.
67. J C Anthony, T G Anthony, S R Kimball, T C Vary, L S Jefferson.Orally administered leucine stimulates protein synthesis in skeletal muscle of postabsorptive rats in association with increased eIF4F formation.J Nutr. 2000 Feb;130(2):139-45.
68. Neil Kubica 1 , Douglas R Bolster, Peter A Farrell, Scot R Kimball, Leonard S Jefferson.Resistance exercise increases muscle protein synthesis and translation of eukaryotic initiation factor 2Bepsilon mRNA in a mammalian target of rapamycin-dependent manner.2005 Mar 4;280(9):7570-80. doi: 10.1074/jbc.M413732200. Epub 2004 Dec 10.
69. Dreyer HC, Fugita S, Cadenas JG, Chinkes DL, Volpi E, Rasmussen B (2006) Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol 576:613–624
70. Baar K, Esser K (1999) Phosphorylation of p70S6k correlates with increased skeletal muscle mass following resistance exercise. Am J Physiol 276:C120–C127
71. Atherton PJ, Babraj J, Smith K, Singh J, Rennie MJ, Wackerhage H (2005) Selective activation of AMPK-PGC-1alpha or PKBTSC2-mTOR signaling can explain speciWc adaptive responses to endurance or resistance training-like electrical muscle stimulation. FASEB J 19:786–788
72. Nader GA (2005) Molecular determinants of skeletal muscle mass: getting the AKT together. Int J Biochem Cell Biol 37:1985–1996
73. Tidball JG (2005) Mechanical signal transduction in skeletal muscle growth and adaptation. J Appl Physiol 98:1900–1908
74. Hyeong Tae Kwon, hyo jeong Kim, Chang Keun Kim. Korea National Sport University, Seoul, Korea, Republic of.The Early Mtor Signaling Responses To Resistance Exercise Stimuli In Skeletal Muscle In Well-trained Athletes .Board #114 June 5.
75. Ruowei, Li.The temporal control of load-dependent anabolic and catabolic pathways in human extensor muscles.Manchester Metropolitan University
76. S Winegrad.Myosin-Binding Protein C (MyBP-C) in Cardiac Muscle and Contractility.Molecular and Cellular Aspects of Muscle Contraction.
77. C M Rembold, R A Murphy.Myoplasmic calcium, myosin phosphorylation, and regulation of the crossbridge cycle in swine arterial smooth muscle.Circ Res. 1986 Jun;58(6):803-15.
78. SAS Gropper,JL Smith,J Groff.Advanced Nutrition and Human Metabolism.GROPPER, Sareen Annora Stepnick, Jack L. SMITH and James L. GROFF. Advanced nutrition and human metabolism. 5th ed. United States: Wadsworth/Cengage Learning, 2009. xvii, 600. ISBN 9780495116578.
79. T P Stein, M D Schluter.Human skeletal muscle protein breakdown during spaceflight.Am J Physiol. 1997 Apr;272(4 Pt 1):E688-95.
80. G Bertolesi,S Mcfarlane.DNA transcription.in: Kirch W. (eds) Encyclopedia of Public Health. Springer, Dordrecht.
81. M Rosenberg,D Court.Regulatory sequences involved in the promotion and termination of RNA transcription.Annu Rev Genet. 1979;13:319-53.
82. J Martin, F U Hartl.Molecular chaperones in cellular protein folding.Bioessays. 1994 Sep;16(9):689-92.
83. Brown EJ, Albers MW, Shin TB, Ichikawa K, Keith CT, Lane WS, Schreiber SL. A mammalian protein targeted by G1-arresting rapamycin-receptor complex. Nature. 1994;369:756–758.
84. Chiu MI, Katz H, Berlin V. RAPT1, a mammalian homolog of yeast TOR, interacts with the FKBP12/rapamycin complex. Proc Natl Acad Sci. 1994;91:12574–12578.
85. Schmelzle T, Hall MN. TOR, a central controller of cell growth. Cell. 2000;103:253–262.
86. Gingras AC, Raught B, Sonenberg N. Regulation of translation initiation by FRAP/mTOR. Genes & Dev. 2001;15:807–826.
87. Dufner A, Thomas G. Ribosomal S6 kinase signaling and the control of translation. Exp Cell Res. 1999; 253 :100–109.
88. Rohde, J., J. Heitman, and M. E. Cardenas. 2001. The TOR kinases link nutrient sensing to cell growth. J. Biol. Chem. 276:9583-9586.
89. Schmelzle, T., and M. N. Hall. 2000. TOR, a central controller of cell growth. Cell 103:253-262.
90. Jefferies H B J, Reinhard C, Kozma S C, Thomas G. Rapamycin selectively represses translation of the 'polypyrimidine tract' mRNA family. Proc Natl Acad Sci USA. 1994;91:4441–4445.
91. Jefferies H B J, Thomas G, Thomas G. Elongation factor-1α mRNA is selectively translated following mitogenic stimulation. J Biol Chem. 1994;269:4367–4372.
92. Thomas G, Thomas G. Translational control of mRNA expression during the early mitogenic response in Swiss mouse 3T3 cells: identification of specific proteins. J Cell Biol. 1986;103:2137–2144.
93. Balendran A, Biondi R M, Cheung P C, Casamayor A, Deak M, Alessi D R. A 3-phosphoinositide-dependent protein kinase-1 (PDK1) docking site is required for the phosphorylation of protein kinase Czeta (PKCzeta) and PKC-related kinase 2 by PDK1. J Biol Chem. 2000;275:20806–20813.
94. Goodman CA, Frey JW, Mabrey DM, Jacobs BL, Lincoln HC, You JS, Hornberger TA. The role of skeletal muscle mTOR in the regulation of mechanical load-induced growth. J Physiol 589: 5485–5501, 2011.
95. Hardie DG. AMP-activated/SNF1 protein kinases: conserved guardians of cellular energy. Nat Rev Mol Cell Biol. 2007;8:774–785.
96. C S Rubin, O M Rosen.Protein phosphorylation.Annu Rev Biochem. 1975;44:831-87.
97. M J Hubbard , P Cohen.On target with a new mechanism for the regulation of protein phosphorylation.Trends Biochem Sci. 1993 May;18(5):172-7.
98. Tipton KD, Wolfe RR. Exercise, protein metabolism, and muscle growth. Int J Sport Nutr Exerc Metab. 2001;11:109–132.
99. Hornberger TA, Esser KA. Mechanotransduction and the regulation of protein synthesis in skeletal muscle. Proc Nutr Soc. 2004;63:331–335.








![[人物誌] Uzi——神亦凡人](http://img.jasve.com/2024-7/58bbf45297decef284331d3e294a4da2.webp)


