上期我們回顧了CAR-T療法的發展歷史,詳情可點選檢視: CAR-T發展歷史及展望 。在此基礎,本期我們聚焦CAR-T治療實體瘤所面臨TME挑戰。
已上市產品和已有研究顯示,CAR-T療法對於血液腫瘤效果顯著。雖然表現各異,但總體來看,CAR-T療法在治療難治復發性B細胞急性淋巴細胞白血時可達到約90%完全緩解率,而在治療B細胞淋巴瘤時可以達到約70%完全緩解率。除此之外,部份臨床顯示,大約有20%的患者接受CAR-T治療後可以獲得長期生存(即醫學上的治愈)。CAR-T療法對於血液腫瘤的驚人療效,是目前其他治療手段所無法達到的。
CAR-T在腫瘤微環境中面臨哪些挑戰?已上市產品和已有研究顯示,CAR-T療法對於血液腫瘤效果顯著。雖然表現各異,但總體來看,CAR-T療法在治療難治復發性B細胞急性淋巴細胞白血時可達到約90%完全緩解率,而在治療B細胞淋巴瘤時可以達到約70%完全緩解率。除此之外,部份臨床顯示,大約有20%的患者接受CAR-T治療後可以獲得長期生存(即醫學上的治愈)。CAR-T療法對於血液腫瘤的驚人療效,是目前其他治療手段所無法達到的。
然而,根據2020年數據顯示,中國癌癥死亡人數前十的癌癥分別是,肺癌71萬,肝癌39萬,胃癌37萬,食道癌30萬,結直腸癌29萬,胰臟癌12萬,乳癌12萬,神經系統癌癥7萬,白血病6萬,宮頸癌6萬。十種癌癥占癌癥死亡總數達到83%,僅有白血病一項是血液腫瘤。CAR-T技術必須拿下實體瘤。CAR-T治療實體瘤的探索一直沒有停歇。2015年4月,諾華與賓夕法尼亞大學初步證明了CAR-T療法在實體瘤中的安全性和有效性。然而四年後的2019年12月,諾華傳出訊息,將暫時放棄CAR-T治療實體腫瘤,而臨床試驗的不順被認為是導致放棄的原因之一:以間皮素MESOTHELIN為靶點的CAR-T療法CART-meso臨床實驗效果並不明顯,參與試驗的19名患者中,僅有4人達到病情穩定。此外,臨床安全性也受到了質疑,2010年Morgan等人報道,一位轉移性結腸癌患者在接受靶向HER2的CAR-T治療後死亡,後發現是CAR-T辨識到肺上皮細胞低水平的HER2而觸發釋放大量細胞因子導致的。科學家指出CAR-T靶向實體腫瘤之所以受到較多限制,主要原因來自於實體瘤的特殊免疫環境。
一、腫瘤微環境對CAR-T細胞造成了哪些阻礙?
實體腫瘤與血液瘤最重要的區別就是實體瘤存在腫瘤細胞微環境(TME)的特點。腫瘤微環境指的是腫瘤的發生、生長及轉移與腫瘤細胞所處的內外環境有著密切關系,它不僅包括腫瘤所在組織的結構、功能和代謝,而且亦與腫瘤細胞自身的(核和胞質)內在環境有關。

TME的復雜環境往往利於腫瘤生長,而不利於包括CAR-T細胞在內的人體免疫細胞生存。因此,了解腫瘤微環境的機理,對設計可以治療實體瘤的新型CAR-T療法具有重大意義,目前已知腫瘤微環境造成的障礙主要有: 1、血管障礙與基質障礙 TME在癌細胞從早期浸潤到逐漸轉移的過程中有利於腫瘤血管生成。這些腫瘤血管是由於位於腫瘤基質中的成纖維細胞(CAFs)和多種生長因子的調控而生成的。(如血管內皮生長因子VEGF、轉化生長因子TGF、血小板衍生生長因子PDGF等。)這種TME環境下的異常脈管系統與正常血管結構不同,一方面,TME下的異常脈管系統可以支持適宜腫瘤生長的低氧和酸性環境,另一方面,這種環境會導致T細胞存活率下降,功能衰竭,這些血管屏障使得CAR-T細胞很難在腫瘤內部遷移,同時令腫瘤更易於轉移。TME的基質屏障由結締組織形成,作為結締組織,基質屏障本身具有物理上的妨礙作用,阻礙CAR-T細胞無法入內,降低CAR-T運輸效率。從構成上來看,這種胞外基質(ECM)包含多種成分,包括膠原蛋白、蛋白聚糖、纖連蛋白、層黏連蛋白等。實體瘤中,膠原蛋白和纖連蛋白提供細胞結構支撐。蛋白聚糖有助於生長因子和細胞因子結合特性。其中,源於基質相關因子諸如ISF-1,IGF-2等能夠促進腫瘤細胞的浸潤,胞外基質中PI3K等細胞訊號則途徑調節腫瘤的生長。此外,ECM中的非結構性基質蛋白如如硫酸乙酰肝素蛋白聚糖(HSPG),能夠促進腫瘤細胞的增殖與遷移,因此需要增加CAR-T細胞降解富含基質的ECM能力。 2、免疫檢查點 免疫檢查點是維持自身耐受性和調節免疫反應訊號通路的關鍵因子。透過幹預與影響T細胞免疫應答發揮作用,保護機體免於自身免疫和炎癥的傷害。當免疫檢查點無法正常發揮功能時,會引起腫瘤耐受,使得腫瘤細胞逃逸免疫系統的追殺。例如,程式性死亡因子1(PD-1)會與腫瘤細胞表面的PD-L1結合誘導CAR-T細胞衰竭、雕亡。粘蛋白分子3(TIM-3)也有類似功能,可誘導效應CD8+ T細胞衰竭,促進Tregs的免疫調節功能TIM-3高表達常常提示患者預後不佳。CTLA-4是T淋巴細胞表面表達的一種蛋白受體,與B7-1結合或B7-2結合可下調T細胞的免疫應答。LAG-3可傳遞抑制訊號,降低效用T細胞的殺傷作用,同時能促進Tregs的免疫抑制功能。對這些免疫檢查點的了解有助於設計新型CAR-T細胞,提升治療效果。
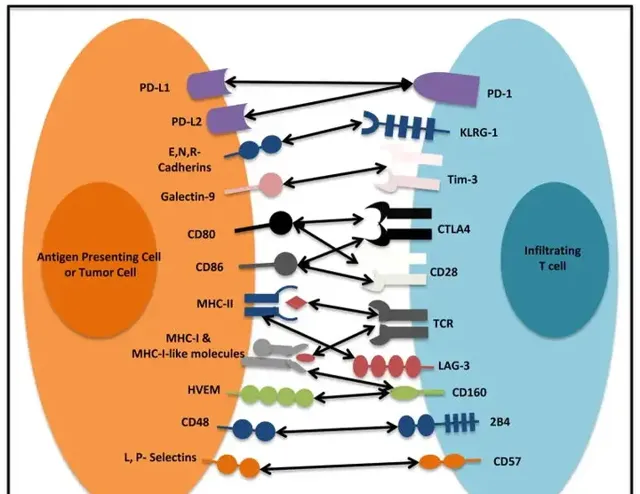
3、免疫抑制細胞及細胞因子抑制細胞: T 細胞(Tregs) 透過其抑制功能來防止由於過度或不必要的免疫啟用而導致的自身免疫和組織損傷,在維持自我耐受和免疫穩態中具有重要作用。然而,在腫瘤微環境中,Treg細胞透過其高親和力IL-2受體從周圍攝取IL-2,使其無法用於反應性T細胞。

骨髓來源的抑制性細胞 (myeloid-derived suppressor cells,MDSCs)由骨髓經血液迴圈,流向炎癥部位和實體瘤。在TME的炎性環境中,MDSC的兩種亞型均可抑制T細胞。
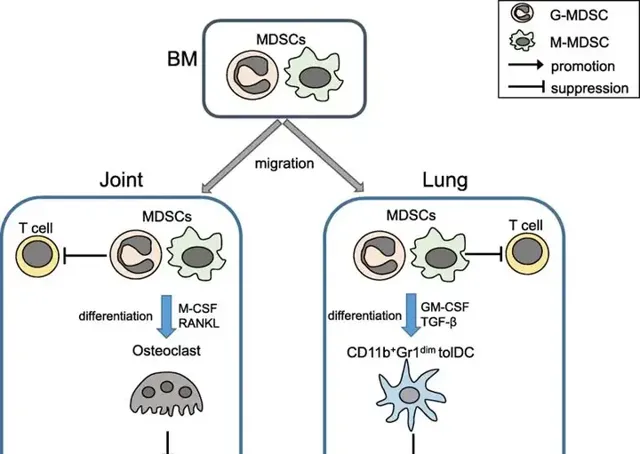
圖腫瘤相關的嗜中性球( tumor associated neutrophils,TAN)在腫瘤的生長和進展中展現出雙重性,TAN可以透過釋放ROS和嗜中性球彈性蛋白酶來介導腫瘤細胞殺傷,透過釋放ROS抑制腫瘤細胞轉移,並在抑制TGF-β後增強抗腫瘤T細胞反應。同時TAN還可透過釋放ROS促進遺傳不穩定,透過彈性蛋白酶促進腫瘤細胞增殖;透過釋放VEGF、MMP-9 或Bv8維持血管生成;透過可溶性介質增強腫瘤細胞的侵襲性;透過表達由TGF-β驅動的精胺酸酶有效地抑制抗腫瘤CD8 + T細胞免疫反應。 細胞因子: 白介素10 (IL-10),也被稱為人類細胞因子合成抑制因子(CSIF),是一種抗炎細胞因子。人體中白介素10是由IL10基因編碼的。IL-10訊號透過兩個IL10同源二聚體與一個由兩個IL-10受體-1和兩個IL-10受體-2蛋白組成的異源四聚體受體復合物傳遞。下遊透過JAK1和Tyk2分別磷酸化IL-10受體1+IL-10受體2的胞質尾端來誘導STAT3訊號傳遞。IL10透過活化的巨噬細胞來抑制炎癥因子如TNF、IL-6、IL-1的表達。由於IL-10作為一種免疫抑制細胞因子被廣泛接受,因此人們認為IL-10可以透過降低腫瘤微環境中的抗腫瘤免疫反應來促進腫瘤免疫逃逸;但也有一些其他研究發現,IL-10對腫瘤患者長期生存所必需的血管生成和轉移有根除和抑制作用。Indoleamine 2,3-dioxygenase 1(IDO 1)是代謝通路中一種非常重要的細胞因子,能夠將色胺酸分解為犬尿胺酸。IDO的活性導致了腫瘤微環境中色胺酸的減少以及犬尿胺酸數量的增加。犬尿胺酸主要與芳基碳氫化合物受體(AhR)進行結合,這個受體是免疫細胞的胞內可溶性受體,能夠導致調節性T細胞的增殖。因此犬尿胺酸數量的增加會抑制效應T細胞的啟用,分化以及活性。而腫瘤細胞能夠透過啟用抗原遞呈細胞IDO活性,實作免疫抑制或者免疫逃逸。
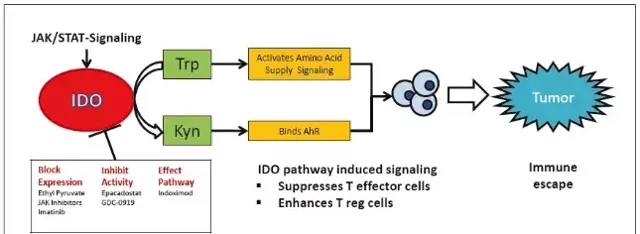
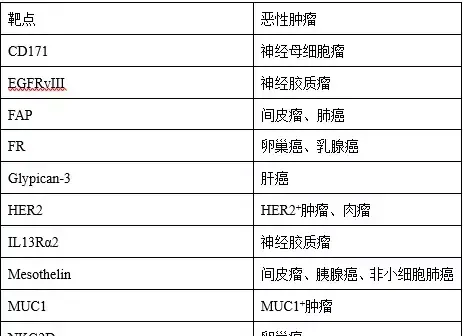
TGF-β細胞因子被證明不僅能直接抑制T細胞的效應功能,還能促進T細胞分化成Tregs,促進Tregs調節免疫功能導致腫瘤細胞逃逸。此外,還有一部份細胞因子與癌細胞生長情況有直接關系,比如說,IL-6訊號通路能夠透過IL-6受體調控細胞生長分化,有研究表明IL-6訊號通路是非小細胞肺癌的發病機制之一,能夠促進該腫瘤生長。在肺腺癌和鱗狀細胞癌中,IL-33表達與腫瘤分級及腫瘤大小呈負相關,IL-33 mRNA高表達的肺腺癌患者預後較好。實體腫瘤可過表達趨化因子,如CXCL10、CXCL12、CXCL14等,參與腫瘤的生長、轉移及血管。了解這些與腫瘤生長相關的細胞因子,有助於設計新型CAR-T細胞,提高歸巢能力。 4、靶點選擇問題 實體瘤之間具有高度異質性,可轉移性,因此很難篩選到合適的表面抗原,這也意味著在腫瘤轉移過程中,原發性腫瘤,繼發性腫瘤,或同一腫瘤的不同部位之間,標靶是有可能不同的。目前大部份研究選用的腫瘤相關性抗原在正常組織中會少量表達,導致CAR-T細胞產生脫靶毒性。顧名思義,脫靶毒性就是CAR-T細胞在攻擊癌細胞的過程中,會無可控地攻擊正常人體細胞,造成嚴重後果。上述以HER2作為靶點的CAR-T療法事故,就是CAR-T細胞錯誤辨識到了結腸癌患者的肺上皮細胞低水平的HER2而觸發細胞因子風暴,產生肺水腫導致患者多器官衰竭致死。此外,在一項靶向表皮生長因子受體變異體III(EGFRvIII)的研究中發現,CAR-T細胞輸液後,部份患者中標靶抗原水平降低,療效並不顯著。經檢測,患者腫瘤表面的EGFRvIII發生廣泛突變,導致CAR-T無法辨識變異的抗原。這也意味著腫瘤生長過程中有可能發生突變,導致治療靶點發生改變。解決靶點問題,是實體瘤面臨的首要任務。目前的熱門靶標包括HER2、EGFR、間皮素(mesothelin)、FAP、CD171、PSMA、GPC3、FR、NKG2D等等。
二、CAR-T細胞針對腫瘤微環境有什麽策略?
1、提高定向運輸能力 使用合適的運輸方法對CAR-T治療有重大意義。如上文所述,CAR-T細胞向實體瘤部位運輸效率很低。因此Brown等采用局部遞送的方法將 CAR- T 細胞顱內遞送至 3 例復發性膠質母細胞瘤患者切除腔中,有兩名患者在切除切緣未見腫瘤復發。運輸過程中,T細胞會表達各種趨化因子受體來向腫瘤部位遷移,然而腫瘤細胞表達的趨化因子往往與其不匹配,限制了CAR-T細胞向腫瘤部位的運輸。CXCR2,CCL2,CCR2b等趨化因子是導向研究的關鍵。 2、防範脫靶毒性 為了防止CAR-T細胞的脫靶毒性,定向局部/區域註射CAR-T細胞這種方法已經在不同程度上對實體腫瘤患者進行了測試,並取得了一定成功。對轉移性乳癌患者的一項0期臨床表明,在腫瘤內註射c-Met CAR-T是安全的,小鼠實驗也證明了這一點。美國加州大學舊金山分校(UCSF)的研究人員設計了一種「智慧」的CAR-T細胞。利用稱為synNotch的基因表現調控系統,引導CAR-T細胞辨識在部份癌細胞中高特異性表達的EGFRvIII,然後激發辨識EphA2或IL13Rα2的CAR的表達。這兩種蛋白在所有癌細胞中都表達,進而可以指揮T細胞消滅所有的癌細胞。雖然EphA2或IL13Rα2也在部份健康細胞中表達,但在synNotch系統的調節下,辨識它們的CAR只會在遷移到腫瘤中的T細胞上表達,因此健康細胞不會受到這些CAR-T細胞的攻擊。目前,已經開發三類雙特異性CAR來解決此類問題,即雙重CAR、串聯CAR( Tan CAR)和抑制性CAR(iCAR) ,當腫瘤細胞表面同時存在兩種靶抗原時,該型別CAR-T細胞才能被啟用,顯著增強特異性,從而使旁觀者細胞不受影響。 3、抑制腫瘤微環境中的免疫檢查點 抑制腫瘤微環境內部的免疫檢查點一直都是抗癌研究的重要部份。PD-1作為免疫檢查點的重要部份,在CAR-T技術中也能夠運用到。利用CRISPR/Cas9技術幹擾T細胞表面PD-1基因的表達(或將其敲除),可以提高細胞因子分泌,增加CAR-T的抗腫瘤能力。這一策略也可以運用於TIM-3、CTLA4等訊號回路中,促進細胞生長。目前該策略的成果頗豐。 4、避免細胞因子和細胞的抑制作用 抗組織中粒系分化抗原(Gr-1)抗體、抗顆粒球巨噬細胞集落刺激因子(CM-CSF)抗體、訊息傳遞與轉錄啟用子-3(STAT3)可以抑制髓源性抑制細胞MDSCs,防止這些異質性細胞群在腫瘤內轉化生長因子(TGF)和白介素(IL)等細胞因子分泌及表達PD-L1結合T細胞上的PD-1,抑制T細胞滅殺作用。IL-12可透過再活化TIL、募集NK細胞到腫瘤部位及抑制Tregs、MDSCs、TAM的免疫抑制 作用等機制調節腫瘤微環境。NK細胞活化受體NKG2D與T細胞受體的細胞毒性ζ鏈融合(NKG2D.ζ-NK),可消滅過表達NKG2D配體的MDSCs,促進CAR-T細胞向腫瘤部位聚集,從而提高CAR-T細胞抗腫瘤作用。TGF-β-CART細胞可避免TGF-β介導的抑制作用,減少TGF-β誘導T細胞向 Tregs分化,提高CAR-T細胞的細胞毒性作用。著名CAR-T療法先驅Carl June博士聯合建立的Tmunity公司開發的一款新一代CAR-T療法就采用了表達阻斷TGF-β訊號通路的策略。盡管目前該款產品在臨床中遇到了神經毒性致死的問題,這一策略在胰臟癌中觀察到了顯著PSA水平下降。 5、改變腫瘤微環境的物理結構和生物化學特性 TME中含有高水平的抗氧化劑(如過氧化氫),可幹擾CAR-T細胞功能,誘導CAR-T細胞產生過氧化氫酶,可增強CAR-T細胞對氧化應激的抵抗力及抗腫瘤能力。癌癥相關的成纖維細胞(CAF)促進血管生成,有助於實體瘤的進展和轉移,因此 Schuberth等構建了靶向成纖維細胞活化蛋白(FAP )的CAR-T 細胞,在體外以抗原特異性方式裂解 FAP 陽性間皮瘤細胞和炎性成纖維細胞,成功抑制了 FAP 陽性人類間皮瘤細胞在小鼠腹膜腔的生長,顯著延長了小鼠的生存期。FAP-CAR-T也因此成為目前實體瘤研發的熱點。實體腫瘤中血管異常化生成可阻礙T細胞浸潤,促進腫瘤生長。整合素αvβ3 可在某些實體腫瘤血管內皮細胞過表達,而鋸鱗血抑肽與整合素αvβ3有高親和力。CAR-T細胞靶向鋸鱗血抑肽(T-eCAR)可透過破壞腫瘤血管生成抑制腫瘤生長,有效縮小腫瘤體積。T細胞代謝途徑的修飾也為抵消免疫抑制性TME提供另一種思路。T細胞的活化增殖以及發揮效應功能需要糖解作用提供能量, 然而腫瘤細胞擴張需要更多的能量,對T細胞的有效活化具有競爭性抑制作用。可以透過在體外培養時限制糖解作用代謝來保留其抗腫瘤活性,如外源精胺酸補充體外培養基抑制T細胞糖解作用代謝,同時促進氧化途徑,導致體內細胞永續性和抗腫瘤活性增加。
三、展望未來
根據美國臨床試驗註冊庫的數據,以實體瘤作為病癥(Solid Tumor)的CAR-T為詞條搜尋可知,目前共有53項CAR-T實體瘤臨床實驗正在進行,都處於I期至II期臨床,其中共有24項處於II期臨床。臨床實驗絕大多數集中於北美和東亞地區,目前中國已經成為CAR-T實體瘤的第一大臨床實驗基地。

對血液系統惡性腫瘤的顯著療效證明了CAR-T在癌癥治療領域有著裏程碑式的意義。然而,目前CAR-T細胞治療實體瘤仍充滿了未知。毫無疑問,TME是復雜的。因此,目前CAR-T細胞正在更趨向於通用性,多靶點性,常常與其他靶點藥物聯用抗擊癌癥。CAR-T「大牛」Carl June教授在 Frontiers in Immunology上發表了綜述,他認為實體瘤治療形勢仍然嚴峻,CAR-T的治療視窗應當在安全性確保的情況下進一步擴大。這也是CAR-T細胞療法未來的趨勢。我們也期待實體瘤CAR-T的臨床實驗能夠為中國患者帶來更多的福音。 去年7月,CAR-T大牛Carl June教授還提到了NK細胞療法,他說NK細胞療法可能顯著推進腫瘤免疫學領域,他相信NK細胞和T細胞領域具有極大的協同作用。那麽像NK細胞那樣有可能用於協作的免疫療法又有哪些呢?他們的臨床目前又到了什麽階段?下一篇將總結目前進入臨床的其他細胞療法。參考文獻: 1. https:// xw.qq.com/cmsid/2021032 5A0EYON002 . https://www. ncbi.nlm.nih.gov/pmc/ar ticles/PMC3636159/3 . 關麗萍,蔣敬庭,吳昌平.CAR-T細胞治療突破實體腫瘤微環境新策略的研究進展[J].臨床腫瘤學雜誌,2020,025(003):264-2674. 武少賢,蔣敬庭.基於腫瘤微環境的CAR-T細胞療法研究現狀[J].中國免疫學雜誌,2020,036(009):1031-10365. 徐玉清.CAR-T及CAR-T在治療實體腫瘤中的套用——前景展望和現實問題[C]//第九屆中國腫瘤內科大會、第四屆中國腫瘤醫師大會暨中國抗癌協會腫瘤臨床化療專業委員會2015年學術年會.20156. MORGAN R A,YANG J C,KITANO M,et al.Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced With a Chimeric Antigen Receptor Recognizing ERBB2[J]. Mol Ther,2010,18(4):843-851.7. https:// baike.baidu.com/tashuo/ browse/content?id=954bc47ea628fa8666d5a01e8 . https://www. sohu.com/a/335267685_68 22599 . Brown CE,Badie B,Barish ME, et al. Bioactivity and safety of IL13r alpha2-redirected chimeric antigen receptor CD8 + T cells in patients with recurrent glioblastoma[ J]. Clin Cancer Res,2015,21(18):4062-407210. Katz SC, Burga RA, McCormack E, et al. Phase I hepatic immunotherapy for metastases study of intra-arterial chimeric antigen receptor-modified T-cell therapy for CEA+ liver metastases [J]. Clin Cancer Res,2015,21(14):3149-315911. https://www. baidu.com/link? url=2aIWgBG2mHyauEEzdb0sc8mWpa7KRupYZqBiC1utBB8YmaVt_Cy-alshk0WBgwu-ODkVm25bN8dleboS4LnIMoNdnQo9Glepftz22EXzi5O&wd=&eqid=d491efeb00275b4a0000000460b8ee59
12. https:// clinicaltrials.gov/
FYI:總結生物醫藥更多知識點,敬請關註公眾平台「佰傲谷BioValley」
部份圖源網路,侵權聯刪











