原創 驕陽似我 圖靈基因 2021-12-25 21:26
收錄於話題#前沿生物大數據分析
撰文:驕陽似我
IF:49.962
推薦度:⭐⭐⭐⭐⭐
亮點:
1.本文使用單細胞譜和譜系追蹤(SPLINTR)追蹤三種臨床相關的急性髓系白血病小鼠模型中的等位基因複制。發現惡性複制優勢是一種細胞固有的遺傳特性,透過抑制抗原呈遞和增加分泌性白血球肽酶抑制劑基因(Slpi)的表達來促進,從遺傳學上證實Slpi是急性髓系白血病的調節因子。
2.轉錄異質性的增加是一個特征,使複制適合於不同的組織和免疫微環境,並在遺傳上不同的複制之間進行複制競爭。與造血幹細胞類似,白血病幹細胞(LSC)顯示出可遺傳的複制固有特性,即高複制輸出和低複制輸出,這有助於整個腫瘤品質。本文證明,LSC複制輸出決定了對化療的敏感性,盡管高輸出和低輸出複制對治療壓力的適應不同,但它們在LSC程式表達增加的情況下協調地從最小殘留疾病中出現。
3.總之,這些數據為支持惡性複制適合性的非基因轉錄過程提供了基本的見解,並可能為未來的治療策略提供資訊。
發育背景下的譜系追蹤研究表明,存在細胞固有的遺傳特性,指導細胞命運潛能和複制動態。然而,關於非遺傳多樣性如何決定惡性環境中複制行為的時間分析仍有待建立。急性白血病是由涉及混合系白血病(KMT2A,也稱為MLL1)基因易位的致癌融合引起的,它在人類癌癥中提供了一個罕見的例子,即單一的基因異常既有必要也足以導致侵襲性的、通常是致命的惡性腫瘤。這些突變惰性和遺傳穩定性的癌癥提供了理想的模型系統來研究非遺傳過程導致複制優勢的原理。
近期,在
Nature
雜誌上都發表了一篇名為「
Non-genetic determinants of malignant clonal fitness at single-cell resolution
」的文章,文章中開發了一種稱為SPLINTR的表達條形碼策略。而且為了能夠同時和/或連續跟蹤多個細胞群,構建了三個高度多樣性的庫,每個庫都具有不同的條形碼結構,並與不同的熒光色素相耦合。SPLINTR條形碼可以使用3′單細胞RNA測序(scRNA seq)方法輕松捕獲,無需額外的PCR富集,並且可以與匹配的DNA條形碼測序相當的頻率進行辨識。由於條形碼主要以單個細胞拷貝的形式存在,因此它們能夠以時間分辨的方式準確描述複制命運和基因表現。

為了了解不同的二級突變如何影響複制適合度,從野生型或同基因C57BL/6小鼠中產生了三種遺傳上不同的MLL-AF9白血病,其中在Flt3(Flt3ITD)或Kras(KrasG12D)中存在內源性敲入啟用突變。外顯子組和低覆蓋率全基因組測序顯示可忽略的遺傳異質性,從患病小鼠收集的白血病細胞中沒有結構重排和其他急性髓系白血病(AML)驅動突變。為了檢測這些不同AML基因型的特性,用獨特的SPLINTR條形碼庫對每一株系進行條形碼編碼,並分別移植到小鼠體內。每種基因型都證明了每只小鼠體內複制組成、複制大小和組織偏好的一致性。數據表明,無論致癌基因型如何,複制優勢是疾病起始複制的細胞固有特性。為了了解這種固有的複制適應力,在移植前立即評估了致病複制祖先的轉錄組。盡管白血病起始複制聚集在一起,表明其轉錄狀態具有共性,但來自每個基因型的致病複制也不共享同一基因表現模式。然而,最顯著的共同點是Slpi在白血病起始複制的祖先中的高表達,特別是在MLL-AF9+KrasG12D組中。
人類癌癥很少由同基因複制介導。因此在遺傳多樣性複制之間的複制競爭的背景下研究這些複制優勢原則。為了實作這一點,將混合基因型MLL-AF9細胞以相等的比例(以下簡稱競爭1:1:1)或傾斜的比例(以下簡稱競爭80:15:5;80%MLL-AF9;15%MLL-AF9+Flt3ITD;5%MLL-AF9+KrasG12D)移植到小鼠,這更準確地反映了臨床上發現的惡性亞複制結構。雖然單個基因型在小鼠中顯示出可重復的複制優勢模式,但兩個競爭組小鼠在複制生長方面表現出更大的差異。雖然同基因MLL-AF9+KrasG12D白血病中的幾個顯性複制也是在競爭環境中引發的疾病,但現在發現了幾個競爭特異性MLL-AF9+KrasG12D複制,它們僅在遺傳上不同的複制之間競爭的情況下顯示出適合性。競爭特異性和等基因致病性複制廣泛聚集在一個相似的位置,但競爭特異性複制顯示出更大的轉錄異質性,這一特征與環境壓力環境下的適應潛力相關。總之,結果表明複制優勢受遺傳多樣性複制之間競爭的影響,在這種情況下,轉錄異質性可能促進惡性複制適合性。圖1 |複制優勢是細胞固有的。

為了研究不同的免疫和組織微環境對複制優勢的作用,將一組相同的SPLINTR條形碼白血病細胞移植到一組免疫缺陷(NSG)小鼠或免疫活性(Ptprca)小鼠中。註意到白血病起始複制在轉錄聚集在一起的所有微環境中共享,並顯示了顯性複制的特征,包括豐富的LSC程式和Slpi的過度表達。這些轉錄因子均二聚或異源二聚,作為髓系細胞的主要調節因子發揮作用,盡管表達了多個家族成員(Cebpa/b/d/e),但只有Cebpe在白血病起始複制占據的區域表現出差異表達。值得註意的是,在不同微環境的優勢複制中,Cebpe表達的增加經常與Slpi表達重疊。在以前的LSC遺傳篩查中未發現Slpi,同樣也未發現對Slpi敲除LSC體外生長和生存能力有明顯影響。然而,當研究Slpi在體內的重要性時,觀察到明顯的證據表明,Slpi的降低顯著損害複制適應力。與這些數據一致,SLPI在伴有MLL融合和急性早幼顆粒球白血病(PML-RARA)的AML患者中表達最高,未經治療的AML亞型具有最具侵襲性的自然史。圖2 | Slpi調節體內惡性複制優勢。
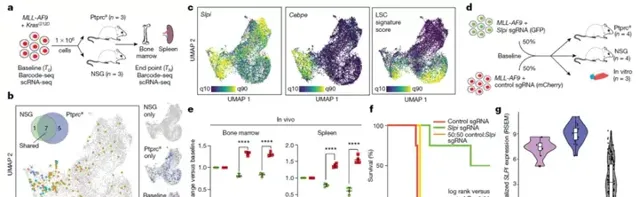
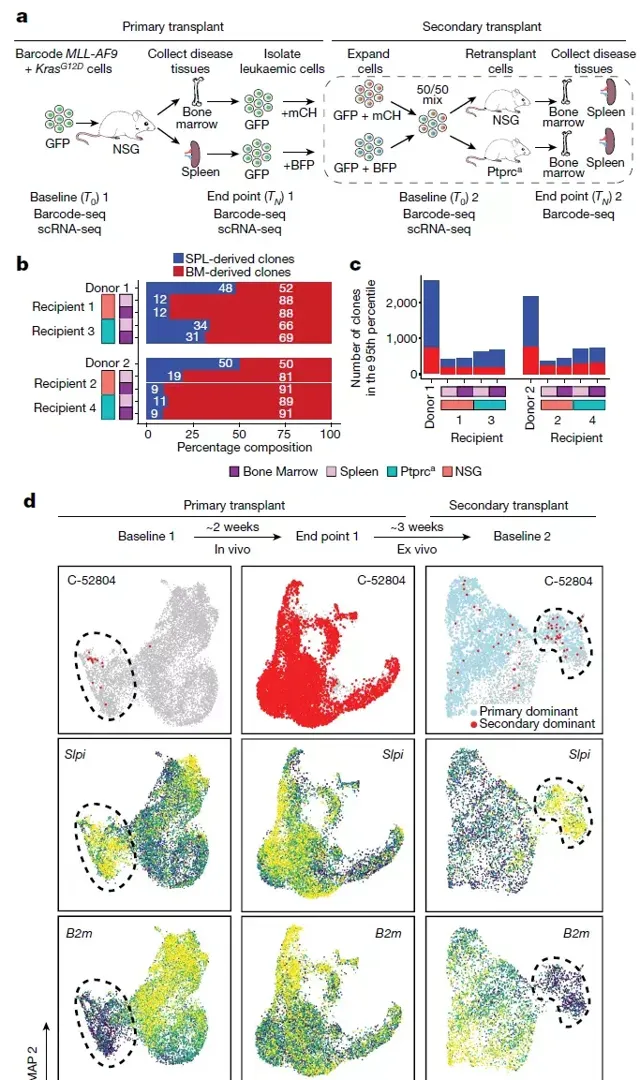
所有的體內實驗都確定了在癌癥起始複制中富集的預先存在的細胞固有轉錄狀態。為了測試這些轉錄狀態是否是可遺傳的,從患病小鼠的骨髓和脾臟中分離出SPLINTR GFP標記的MLL-AF9+KrasG12D細胞,並用獨特的SPLINTR文庫對這些細胞重新編碼,從而使這些白血病起始複制具有GFP和mCherry(來源於骨髓)或GFP和BFP(來源於脾臟)條形碼的獨特組合。重新編碼的細胞按相同比例混合並移植到受體NSG或Ptprca小鼠體內。盡管供體白血病的GFP條形碼在受體中的分布保持不變,但只有骨髓或脾臟來源的複制的一部份能夠在受體中重現該疾病,表明除了複制間的異質性外,複制內的轉錄差異(複制內異質性)也決定了惡性適合性,並且並非所有的同基因複制兄弟姐妹都能使疾病永久化。這些發現提供了一些最有力的證據,排除了觀察到的複制優勢的潛在隱性遺傳驅動因素。有趣的是,來自骨髓的複制構成了大多數疾病負擔,髓外複制的疾病起始能力明顯受損。這些有趣的發現意味著癌癥起始細胞的固有轉錄/表觀遺傳學特征在癌癥起源細胞的自然微環境中保存得最好。為了確定LSC各代間遺傳傳遞的共同轉錄特征,列舉了每個細胞中存在的特定條形碼對,並檢查了次要受體骨髓或脾臟中主要-次要條形碼對的基因表現和聚類模式,這些條形碼對包括顯性複制(>2%的總疾病負擔)。此外,當跨多代追溯這些疾病起始複制的轉錄狀態時,發現它們聚集在轉錄組空間的一個區域,其特征是Slpi、Cebpe和LSC基因簽名的高表達和B2m的低表達。總之,這些數據為複制適應特性的非遺傳遺傳提供了令人信服的證據,盡管在體外和體內暴露於不同的微環境中,一些細胞仍能穩定地遺傳癌癥發生和生長所需的轉錄狀態。圖3|定義複制優勢的轉錄程式的非遺傳遺傳。
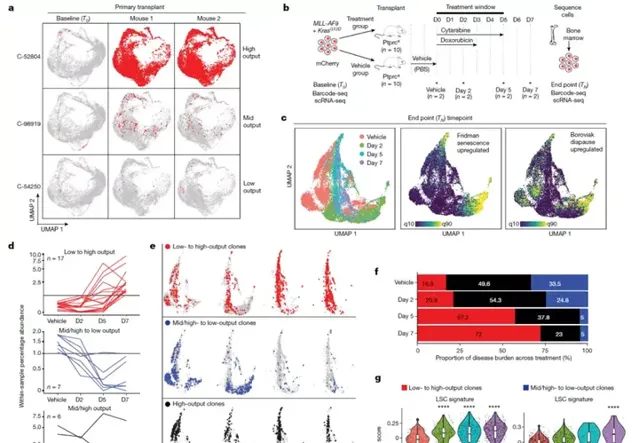
與HSCs中的最新證據類似,LSC複制也可分為高、中或低輸出,並且這種細胞內在行為在不同受體小鼠中高度一致。為了了解這種細胞固有特性是否可遺傳和/或受不同微環境的影響,使用順序組合SPLINTR條形碼策略在連續移植試驗中跟蹤複制行為。接下來,我們研究了LSC固有複制輸出是否能預測對治療的敏感性。盡管不能根除LSC被認為是復發的主要原因,但在複制水平上,很少有分子洞察表現為最小殘留病(MRD)的治療逃避過程。為了解決這個問題,對患病小鼠進行了強化化療(類似於人類AML治療),並收集了一系列MRD樣本,以詳細分析相同複制群體在有和無治療壓力的情況下的行為。數據表明,化療耐藥MRD複制在治療早期采用了不同的轉錄狀態,與AML的衰老和其他休眠狀態相關的轉錄特征顯著豐富。值得註意的是,SPLINTR還能夠揭示LSC固有複制輸出如何影響適應力反應。總的來說,共三種主要模式:(1)高/中產量複制,其中複制產量僅因治療而短暫減少;(2)改變複制行為以采用低輸出狀態的高/中輸出複制;(3)只有在治療過程中,低輸出複制才會轉變為高輸出狀態,從而導致治療後絕大多數MRD負擔。有趣的是,高/中輸出和低輸出化療耐藥複制中的適應力轉錄程式有很大的不同,只有高/中輸出複制在治療激發後主動采用暫時休眠狀態。盡管適應的轉錄途徑不同,但高/中和低輸出複制都匯聚到與LSC潛能相關的協調上調基因,這與幾個組的功能數據一致。圖4 |治療壓力下的複制動力學。
腫瘤內異質性仍然是實作個人化癌癥治療承諾的最大障礙。本文使用SPLINTR以時間分辨的方式同時跟蹤數千個惡性複制,以確定複制適合性的原則,這些原則延伸到癌癥基因組之外。本文的主要發現表明,無論起源於何種細胞,複制優勢是一種細胞固有的遺傳狀態,不能歸因於統一的轉錄程式。相反,本文發現轉錄多樣性的增加是複制適應力的一個一致特征,特別是在更具挑戰性的微環境中。使用SPLINTR,還發現Slpi是惡性複制優勢的典型介體,只有在體內才能辨識。最後,發現癌癥幹細胞對整個腫瘤負擔的貢獻並不均等,惡性複制輸出是一種細胞固有的遺傳特性,決定了適應力過程和對化療的敏感性。值得註意的是,研究需要一個基因簡單的癌癥模型,以便深入了解惡性複制適合性的非基因原理。因此,這些原則需要對更廣泛的癌癥進行進一步評估,以準確辨識遺傳和非遺傳過程對腫瘤內異質性的相對貢獻。
教授介紹:

Mark A. Dawson
Dawson教授是墨爾本大學Peter MacCallum癌癥中心和癌癥研究中心的臨床醫生兼科學家。他是癌癥生物學和治療學計畫的負責人,癌癥表觀遺傳學實驗室的組長和血液學系的血液學顧問。他的研究興趣是研究表觀遺傳調節因子在癌癥的發生,維持和進展中的作用。他是澳洲皇家內科醫學院和澳洲大陸區皇家病理學家學院的院士。在澳洲墨爾本完成臨床培訓後,他被授予著名的約翰·莫奈許爵士獎學金和劍橋大英國協信托獎學金,他用這些獎學金在劍橋大學完成了博士學位。在獲得博士學位後,他被授予首屆惠康信托基金會Beit獎獎學金,以繼續研究白血病幹細胞的表觀遺傳調控。他的研究確定了一系列癌癥的新治療策略,並幫助為一流的表觀遺傳學療法的臨床試驗奠定了基礎。為了表彰他的研究成就,他被選為澳洲科學院院士,澳洲健康與醫學科學院院士,並擔任EMBO會員。他獲得了多個享有盛譽的獎項,包括國際實驗血液學會的McCulloch&Till獎,澳洲科學院的Jacques Miller獎章以及2020年年度總理年度生命科學家獎。
參考文獻:
Fennell, K.A., et al., Non-genetic determinants of malignant clonal fitnessat single-cell resolution. Nature, 2021.







![[連心力場]比耐公式推導](http://img.jasve.com/2024-12/3a84f4f6914dbf07aed33238c6eed920.webp)



