編輯:喬楊 好困
【新智元導讀】 5月釋出的AlphaFold 3有論文、沒程式碼,讓許多機構和團隊紛紛開啟了「復現AF3」的工作。率先做出成果的,是一家成立不到一年的初創Ligo,3位創始人全都是牛津大學的本科生。
谷歌DeepMind5月釋出的AlphaFold 3同時席卷了生物界和電腦科學界,被認為是「有諾獎潛力的成果」。

成就如此卓著、意義如此重大,AF3的成果公開自然讓眾多科學家翹首以盼。
然而, DeepMind 團隊卻潑下了一盆巨大的冷水。他們只放出了論文,並沒有公布任何相關的程式碼或模型權重。

AlphaFold是一項千載難逢的突破,對生物科學產生了巨大影響。我認為它的作者最終會獲得諾貝爾獎,因為他們解決了一個70多年來一直無法破解的巨大問題。我基本上每天都在工作中使用它,指導藥物發現和實驗上有用的HBV聚合酶的工程設計。
最新版本的AlphaFold3比以前更強大。它已經在我的實驗室中揭示了HBV RNA最初如何與聚合酶結合的結構。不幸的是,他們更改了此版本的使用授權,限制了其用於藥物發現。
如今剛剛過去不到4個月,初創公司Ligo宣布——他們已經完成了AlphaFold 3開源復現的工作。

計畫地址:https://github.com/Ligo-Biosciences/AlphaFold3
這個成果相當激動人心,也得到了Figure創始人Brett Adcock的轉發。

Ligo團隊表示,他們正在使用AlphaFold 3的想法來進行酶設計,於是順便開啟了支線任務——復現AF3。
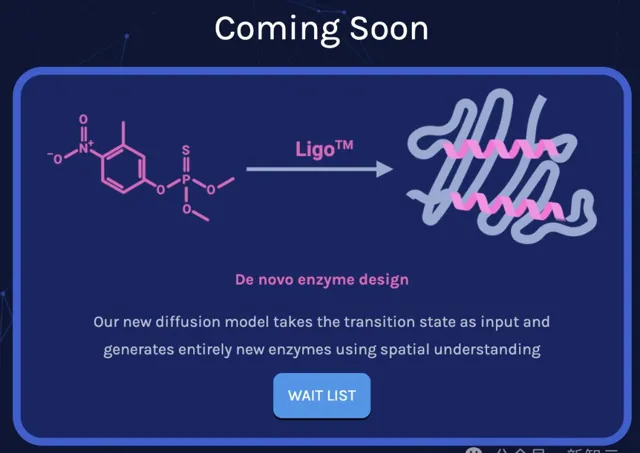
作為生物分子的結構預測模型,AF3主要可以用於三類任務:
-
預測蛋白質結構
-
預測藥物-蛋白質交互作用結構
-
預測核酸-蛋白質復合物結構
這是結構建模技術的根本進步,整個生物科技行業理應從中受益。其套用範圍廣泛,包括:
CRISPR基因編輯技術:科學家可以準確看到DNA如何與「剪刀」Cas蛋白交互作用
癌癥研究:預測潛在藥物如何與癌癥靶標結合,AF3論文的亮點之一就是預測KRAS抑制劑與其靶標的復合物
抗體/奈米抗體的靶向預測:AlphaFold3在這一類分子上的準確性比現有的最佳工具提高了兩倍
而此次Ligo釋出的模型是在單鏈蛋白質上訓練的,可以完成上述三項功能中的第一項,即預測蛋白質結構,其他兩個功能將在不久後完成訓練並釋出。
GitHub倉庫中目前僅公開了程式碼,但團隊表示,一旦訓練和基準測試完成就會釋出權重,而且會使用Apache 2.0授權證,實作「真正的開源」!
計畫地址:https://github.com/Ligo-Biosciences/AlphaFold3
如何「復刻」AlphaFold 3?
由於DeepMind在論文中釋出了模型的完整架構,以及每個元件的 虛擬碼 ,因此任何團隊都有權復現。
但復現這件事,說起來容易,做起來難。
Ligo選擇將其完全轉譯為PyTorch程式碼,其中涉及到不少逆向分析和重構工作,遠多出他們的想象。
復現過程中,他們也發現了原始論文中存在的多個問題,會幹擾訓練,恰好是深度學習領域的關註點,因此一並放出,供社群參考。

1. MSE損失縮放公式有誤
如下圖所示,公式中使用的是加號而非乘號;如果使用加法,就無法在高雜訊水平下正確降低權重,且MSE在初始化時不是單位化的。

這與Karras等人2022年發表的論文不同,可能只是一個筆誤。

原文地址:https://arxiv.org/abs/2206.00364
2. 論文中省略了原DiT包含的殘留誤差層
程式碼中將其添加了回來,並對兩種情況進行了對比實驗,發現引入殘留誤差層可以改善梯度流和收斂性。

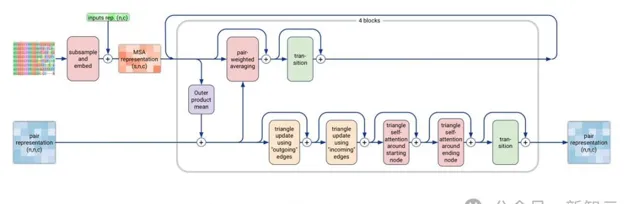
3. 當前形式的MSA模組中存在無效層,
如果使用論文所述的MSA模組的通訊步驟,最後的配對加權平均和轉換層無法對配對表示(pair representation)做出貢獻,因此沒有梯度。
程式碼使用了AlphaFold2中ExtraMsaStack的順序;另一種解決方案是使用權重共享,但論文中是否有此操作尚不明確
除了復刻模型,Ligo團隊也在探索更加快速高效的實作方式。
比如,重用了OpenFold的三角註意力(triangular attention),還將初代AF提出的MSARowAttentionWithPairBias重用於DiT,這是AF3論文中沒有提及的操作。
下面這個動畫由Ligo復現的模型生成(未使用樣版),模型僅使用了8個A100 GPU訓練 10 小時。
分析顯示,盡管進行了最佳化,但模型超過60%的操作仍然受限於記憶體。因此除了擴充套件到更多功能,團隊還在借鑒ScaleFold的理念,致力於實作一個更具擴充套件性、更高效的方案。
「閉源」惹眾怒,3位本科生率先復現
作為一種生物分子結構預測模型,AlphaFold 3大大加速了蛋白質結構的繪制,解決了一個70多年來一直無法破解的巨大問題,因而對科學進步具有極其重要的意義。
研究人員可能需要用讀完一整個博士的時間(4~6年)才能建模出一個結構,但AlphaFold 3只需幾分鐘,即可獲得與實驗精度相當的預測結果。
但除了部落格和論文外,DeepMind只開放了一個伺服器,允許科學家們進行非商業用途的使用,每天呼叫上限為20次。
網站地址:https://gdm-alphafold.corp.google.com/welcome
之所以如此一反常態,「捂緊」AF3的成果,很可能是有商業盈利用途的考量。
他們和新成立的子公司 Isomorphic Labs 正在進軍藥物研發領域,以滿足大型制藥公司的需求。
今年年初,Isomorphic Labs已經與諾華和禮來簽訂了價值30億美元的合約,而最新的AF3的開發也有Isomorphic Labs的貢獻,可被用於加速藥物發現。

雖然為了商業盈利也無可厚非,但這種做法引起了科學家們的強烈不滿。

文章地址:https://undark.org/2024/06/06/opinion-alphafold-3-open-source/
AF3釋出之後的短短兩天,就有600多名科學家聯名向Nature遞交了一封公開信,指責谷歌DeepMind的這種做法不符合科學進步的原則。
同時也是在批評Nature——為什麽在沒有公開程式碼時接收了論文。

在反對的聲浪下,DeepMind沒有頂住壓力,隨後改口表示,會在6個月內公布模型及權重。
Nature也不得不站出來回應,原原本本地向研究者們交代接收論文的考量和依據。

文章地址:https://www.nature.com/articles/d41586-024-01463-0
然而,很多反對者依舊不買賬,畢竟在爭分奪秒的研究領域,6個月實在太久;而且DeepMind出於合作方Isomophic Lab的盈利目的,很可能只會放出「閹割版」。
因此,除了Ligo,很多實驗室和機構都開始了破解、復現AlphaFold 3的工作。

文章地址:https://www.nature.com/articles/s41586-024-07487-w
Ligo所借鑒的OpenFold團隊就是其中之一,由哥倫比亞大學助理教授Mohammed AlQuraishi領頭。
他們此前就對AlphaFold 2進行過復現和重新訓練,成果在今年5月剛剛被Nature接收,程式碼也如數公布。

原文地址:https://www.nature.com/articles/s41592-024-02272-z
倉庫地址:https://github.com/aqlaboratory/openfold
就在發推宣傳這項成果時,Alquraishi表示,AlphaFold 3計畫在進行時了。

此外,GitHub上的開源大佬、舊金山的獨立軟體工程師Phil Wang也組織起了一個眾包開源計畫,同樣是用PyTorch復現AlphaFold 3,正進行得如火如荼。
計畫地址:https://github.com/lucidrains/alphafold3-pytorch
本科生 VS DeepMind
有如此多的競爭者,能在不到4個月的時間率先復現AF3,Ligo這家初創究竟是什麽來頭?
這家YC系初創成立於去年12月,總部位於倫敦,3位創始人都來自牛津,且有豐富的研究經歷。

CEO Edward Harris曾在普林斯頓大學入讀電腦科學系,之後在2021年轉入牛津醫學院,目前正輟學全職創業。
進入牛津前,Harris曾在墨西哥創辦外賣平台Abas2Go,目前年營業額超過120萬美元。
CSO Emily Egerton-Warburton目前在牛津分子和細胞生物化學系學習,曾獲得英國皇家化學學會頒布的化學奧賽金獎。
CTO Arda Goreci是牛津大學生物醫學系的學生,2023年憑借計算生物學方面研究成果入選Google Cloude Research Innovator計劃,他也是AF3開源計畫的主要參與者和領導者。











