近年來,中晚期癌癥患者的治療盲目地進行過多的手術、化療、放療,一味地追求消滅腫瘤,企圖達到完全康復的目的。但殊不知,中晚期癌癥患者由於機體狀態本身就差,過度的治療會嚴重損傷抵抗力,反而容易反復發作,加速死亡。
無癌家園專家 指出,中晚期癌癥的治療不能一味地追求腫瘤的消退,而應該把重點放在 控制腫瘤,延長患者的生存期,實作長期「帶瘤生存」,爭取與腫瘤細胞「和平共處」, 使癌癥也變成糖尿病、心臟病等普通慢性病一樣,才是科學抗癌的正確理念。
近十年來,隨著免疫藥物及靶向藥物的興起,眾多的靶向藥物和免疫藥物紛紛上市,除此之外,各國醫學科研工作者也在積極地研究各種治療癌癥的黑科技,曾經被視為天方夜譚的難治性癌癥,都漸漸地朝著慢性病的方向轉變。
從國情出發,中國的醫療與已開發國家差距較大,許多新藥新療法耗資巨大、價格昂貴,癌友們只能望洋興嘆。但是近兩年來我們國家加快了新藥的審批,以及新技術的研發。在2022年快要過半之際,有多款新藥新技術強勢登陸中國,而且都恰巧在國內有臨床招募,尤其以細胞免疫療法發展最為迅猛!那麽,無癌家園小編今天就迫不及待地給大家介紹這些國際先進前沿新技術新療法!
細胞免疫療法
細胞免疫療法利用的就是人體免疫系統的自我保護及查殺能力,來實作抗腫瘤的作用。 透過把患者體內具有免疫功能的細胞提出體外培養、增殖,透過技術手段讓它們擁有攻擊腫瘤細胞的能力,然後再輸入患者體內,實作自身抗癌。這種療法 針對免疫細胞,而不是癌細胞 ,也不像手術、放療、化療那樣會對患者身體造成巨大危害, 對於早期癌癥患者可以直接治療,特別是配合手術後對殘留癌細胞的攻擊效果最明顯。
從近些年在科研和臨床上的迅猛發展來看,細胞免疫療法在精準性、有效性和安全性等方面更讓人寄予厚望,有望迅速崛起成為抗癌療法的第四大支柱。尤其是到了2022年,細胞免疫療法繼續延續2021年的強勁勢頭,發展更為迅猛,而且有多種療法在國內均在進行臨床招募,覆蓋多樣癌種的患者,讓越來越多的中國癌癥患者得到臨床獲益!
01
CAR-T細胞療法
CAR-T療法就是嵌合抗原受體T細胞免疫療法,是一種治療腫瘤的新型精準靶向療法。透過基因工程技術將T細胞啟用,並裝上定位導航裝置CAR(腫瘤嵌合抗原受體),將T細胞這個普通「戰士」改造成「超級戰士」,即CAR-T細胞,專門辨識體內腫瘤細胞,並高效殺滅腫瘤細胞,從而達到治療惡性腫瘤的目的。
目前,隨著2021年 阿基侖賽註射液、瑞基奧侖賽註射液 先後在中國獲批上市,2022年 西達基奧侖賽被美國FDA獲批上市 ,CAR-T療法已然進入井噴期。尤其是CAR-T技術在多種血液腫瘤,如白血病、淋巴瘤、多發性骨髓瘤中,表現出不俗的療效,讓許多瀕臨絕境、無藥可治的血癌患者,一大半都獲得了良好的療效。
此外,CAR-T療法在胃癌、肝癌、胰臟癌等領域都有著卓越的進步。國內外的學者更是針對CAR-T進行了多種改造,不斷地發現新靶點,以用於治療多種實體腫瘤。

01 爆!中國首款、全球第2款BCMA CAR-T療法獲FDA批準!
2022年2月28日,由楊森公司(Janssen)和傳奇生物合作開發的 BCMA CAR-T產品西達基奧侖賽(商品名Carvykti),已獲得美國FDA批準上市,用於治療復發/難治性多發性骨髓瘤成人患者(MM)。
這是中國首款獲得FDA批準的細胞治療產品,也是全球第二款獲批靶向BCMA的CAR-T細胞免疫療法。

cilta-cel是一種研究性B細胞成熟抗原(BCMA)導向的CAR-T療法,用於治療復發或難治性多發性骨髓瘤(RRMM)。
在2021年的ASH會議上報道的最新結果顯示, 中位22個月的長期隨訪,客觀緩解率(ORR)達到了98%,83%的患者達到嚴格的完全緩解(sCR), 強調隨著時間的推移緩解加深(sCR從2020年ASH年會上報告的67%增加到83%)。 在18個月時,有66%的患者存活且疾病無進展。兩年無進展生存率和總生存率分別為61%和74%。 在2021年ASCO年會上將要公布的最新研究結果顯示, 中位隨訪18個月,總生存(OS)率為81%, 緩解率在全部預先指定的亞組和不同治療線數患者中具有可比性。
相關文章:爆!中國首款、全球第2款BCMA CAR-T療法獲FDA批準!更多癌癥晚期患者將獲益!
自從靶向BCMA的西達基奧侖賽被FDA批準上市外,復發或難治性多發骨髓瘤患者這個群體就受到大家的格外重視,對於這一血液系統的第二大常見惡性腫瘤,CAR-T療法無疑給癌友們提供了新的治療選擇!
目前無癌家園也正有兩款針對 多發性骨髓瘤的CAR-T療法 以及 一款靶向CD19/CD20/CD22的三靶點CAR-T臨床試驗,主要是針對B細胞急性淋巴細胞白血病患者的CAR-T臨床試驗 正在招募中。
02 劍指胃癌,國產CAR-T療法CT041進入確認性Ⅱ期臨床試驗!
作為國際上首個針對Claudin18.2的CAR-T細胞,CT041早在2019年ASCO年會上就嶄露頭角,當時總客觀緩解率為33.3%就已經驚艷世界,如今更加顯著的療效無疑是錦上添花!此次的臨床數據展現出對消化系統腫瘤的良好治療前景!
2022年5月9日,科濟藥業CAR-T細胞產品CT041治療消化系統腫瘤的研究結果發表在國際頂級期刊【Nature Medicine】雜誌上,這也算是 首個發表於頂級學術期刊的迄今為止最大樣本量的CAR-T細胞治療實體瘤的臨床研究!
研究數據格外亮眼!
1. 所有患者的 客觀緩解率達48.6%,疾病控制率達73%; 所有 胃癌 患者 總客觀緩解率為57.1%,疾病控制率達75.0% 。
2. 既往接受至少2線治療失敗的胃癌患者:客觀緩解率為61.1%,疾病控制率為83.3%。
3. 而且總體耐受性良好!
截止到2022年3月3日, CT041成為全球首個且唯一進入到確證性Ⅱ期臨床試驗的用於治療實體瘤的CAR-T細胞候選產品。 這是CAR-T攻克實體瘤領域是裏程碑般的存在,可喜可賀!
除此之外,還有多款靶向CLDN18.2的CAR-T細胞療法。例如,由傳奇生物研發的LB-1904,用於治療胃癌或者胰臟癌,目前已經進入臨床I期試驗。此外, 中國自主研發的首個針對Claudin18.2的單抗AB011 ,用於治療晚期胃腺癌及實體瘤患者,目前也正在進行臨床試驗招募中。
目前急招B細胞淋巴瘤、T細胞淋巴瘤、T細胞白血病(T-ALL)、急性白血病、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲狀腺癌等癌種!

03 靶向結直腸癌!斯丹賽實體瘤CAR-T療法閃耀國際!
2022年5月17日,上海斯丹賽生物公司宣布,其將出席2022年5月15日-5月19日在華盛頓舉行的美國基因與細胞治療學會(ASGCT)第25屆年會並做口頭報告。
會上,斯丹賽將做基於自主研發的CoupledCAR®平台技術開發的正選候選產品GCC19CART的報告,該產品被開發用於治療復發/難治性結直腸癌(R/R mCRC)患者。
2022年4月19日,上海斯丹賽生物宣布,其開發的 實體瘤CAR-T產品GCC19CART被美國食品和藥物管理局(FDA)授予快速通道資格。
GCC19CART是一款自體CAR-T治療產品,是用於治療復發難治轉移型結直腸癌(R/R mCRC)的實體腫瘤領先療法。 不得不說,這項殊榮讓CAR-T療法在攻克實體瘤的道路上又邁出了堅實的一步,可喜可賀!
據無癌家園小編獲悉,在本次ASGCT會議上,斯丹賽將會重點介紹來自中國5家臨床中心2個劑量爬坡試驗組21例患者的數據,驗證了GCC19CART產品的安全性和初步療效。其中13患者以1級劑量(1x106 cells/kg)入組, 8名患者以2級劑量(2x106 cells/kg)入組 。根據實體腫瘤療效評價標準(RECIST1.1),1級劑量組客觀緩解率(ORR)為 15.4%(2/13) , 2級劑量組客觀緩解率為50%(4/8)。
目前,斯丹賽的CAR-T細胞療法進行臨床招募中,主要是關於晚期實體瘤的臨床研究。
其中涵蓋14大癌種,包括結直腸癌、肺癌、乳癌、肝癌、膀胱癌、食道癌、腎癌、卵巢癌、子宮癌、黑色素瘤、胃癌、胰臟癌、滑膜肉瘤、頭頸癌。
02
TCR-T治療
CAR-T細胞和TCR-T細胞都屬於經基因工程技術改造的T細胞。 相較於CAR-T療法,TCR-T療法在實體瘤治療領域具備獨特優勢。
TCR-T細胞療法可辨識細胞膜表面或細胞內來源的腫瘤特異性抗原,已從最開始的基礎免疫研究走進臨床套用,在實體瘤中顯示出初步療效,成為目前最有可能在實體瘤領域中取得突破的T細胞免疫療法!
何謂TCR-T細胞療法?
TCR-T技術主要機制是向普通T細胞中引入新的基因,使得改造過的T細胞能夠表達有效辨識腫瘤細胞的TCR(T cell receptor,T細胞抗原受體),從而引導T細胞殺死腫瘤細胞。
肝癌TCR-T產品獲批臨床情況
2022年5月9日,星漢德生物的SCG101自體T細胞註射液獲得新加坡藥監局(HSA)的臨床試驗批準。而在3月10日,中國國家藥品監督管理局藥品審評中心(CDE)公示顯示,SCG101自體T細胞註射液成功獲得臨床試驗默示特許,用於治療乙型肝炎病毒(HBV)相關的肝細胞癌(HCC)。
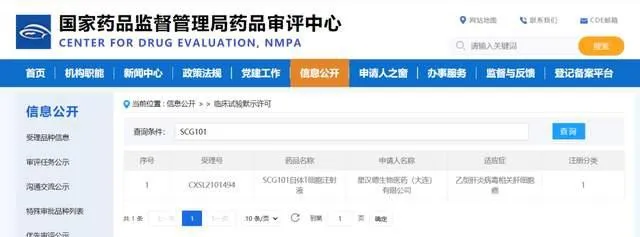
2022年4月20日,香雪生命科學的創新產品TAEST1901註射液,已獲得中國國家藥監局(NMPA)臨床試驗特許,擬用於治療組織基因型為HLA-A*02:01、腫瘤抗原AFP表達為陽性的晚期肝癌或其它晚期腫瘤。

相關文章:重磅!全球首款TCR-T細胞療法獲批上市!實體瘤細胞療法有望迎來突破!
03
CAR-NK治療
近兩年來,除了CAR-T療法備受萬眾矚目外,另外一種新的癌癥細胞療法—— 自然殺傷(NK)細胞療法 也逐漸受到關註。研究人員說, NK細胞 作為一種細胞抗癌療法更具潛力,它可能會更安全、更便宜、更快速。
CAR-T細胞療法取得的成功激發了人們對用CAR基因修飾NK細胞來增強其殺腫瘤能力的熱情。
CAR-NK就是利用基因工程給NK細胞加入一個能辨識腫瘤細胞,並且同時啟用NK細胞殺死腫瘤細胞的嵌合抗體。2020年,CAR-NK免疫細胞治療曾被權威學術期刊【自然-醫學】納入度生物醫學領域的十代矚目進展之一。
大放異彩,CAR-NK療法在實體瘤中的成就不容小覷
1 創新CAR-NK療法FT536獲FDA批準用於臨床試驗
2022年1月10日,Fate Therapeutics公司宣布, 美國FDA已批準FT536的新藥臨床研究(IND)申請。FT536是一款經過多重工程修飾、誘導多能幹細胞(iPSC)衍生的「即用型」嵌合抗原受體(CAR)自然殺傷(NK)細胞療法。

FT536表達一種特異性靶向I類主要組織相容性復合體(MHC)相關蛋白A和B(MICA/MICB)α3結構域的新型CAR。
MICA和MICB屬於應激蛋白,在許多實體瘤上高水平表達。癌細胞經常透過MICA/B的α1和α2結構域的蛋白水解脫落來逃逸免疫細胞辨識。 此前有研究發現, 靶向MICA/B的α3結構域的抗體能夠特異性地阻止MICA/B脫落,恢復NK細胞介導的免疫力。
此次FT536獲批臨床套用, 表明MICA和MICB正在成為廣泛的實體瘤中令人興奮的癌癥免疫療法靶標, 而FT536也代表了一種靶向這些應激誘導配體的新型治療策略。關於此款療法的多中心I期臨床試驗開展的腫瘤類別包括: 晚期非小細胞肺癌、結直腸癌、頭頸癌、胃癌、乳癌、卵巢癌和胰臟癌。
2 「現貨型」CAR-NK療法向「癌王」胰臟癌發起進攻
2022年1月6日,在國際胃腸病領域權威雜誌【Gastroenterology】刊登了希望之城國家醫學中心和細胞療法創新公司CytoImmune Therapeutics合作開發的重磅研究,研究結果顯示,以前列腺幹細胞抗原(PSCA)為靶點的「現成」的CAR-NK療法能夠顯著抑制胰臟癌。
這款被稱為CYTO NK-203的治療方法,是一種現成的同種異體 CAR-NK 細胞療法,源自臍帶血,並具有提高 NK 細胞安全性和殺傷功效的一種潛在的療法。
CYTO NK-203在人類轉移性胰臟癌小鼠模型中效果顯著,在小鼠體內持續存活超過90天,顯著延長其壽命,且未顯示出治療相關毒性,這項臨床前研究支持該療法在今年進入人體臨床試驗。
研究團隊認為這種CAR-NK療法對胰臟癌治療充滿希望,原因有兩個:首先,該療法基於精準醫學方法,靶向胰臟癌患者的特殊靶點——PSCA;這是一種免疫療法,使用工程化的人類自然殺傷細胞,被改造為專門攻擊癌細胞。
此外,由於前列腺幹細胞抗原(PSCA)在胃癌、前列腺癌中也同樣高表達,因為這款CAR-NK細胞療法同樣對胃癌和前列腺癌的治療充滿希望。
除了上述提到的國內臨床研究外, CAR-NK細胞還對卵巢癌、結直腸癌、非小細胞肺癌、膠質母細胞瘤和神經母細胞瘤、肝癌等的療效頗佳 ,特異性辨識和高效殺傷乳癌腫瘤細胞,對多發性骨髓瘤療效顯著。
廣譜抗癌藥
近期,癌癥靶向治療進展非常迅速,無論國內外,均有不少高效的靶向藥紛紛獲批上市或投入使用。就在2022年剛剛結束不久的美國腫瘤研究協會(AACR)年會上,眾多備受癌友們關註的靶向藥如雨後春筍般不斷湧現,讓無數癌友重新點燃生的希望。那麽,今天無癌家園的小編就盤點下熱門靶向藥的最新臨床研究。
「鉆石」靶點——NTRK
NTRK之所以被稱為「鉆石」基因,首先是因為它非常罕見,在中國常見的肺癌、乳癌、結直腸癌中,只有1%~5%的患者存在這種突變,而一些罕見的癌癥,比如 嬰兒纖維肉瘤和分泌型乳癌,存在NTRK融合的頻率卻高達90%~100%。 其次,針對NTRK融合突變上市的藥物及在研的藥物臨床效果顯著,接受治療的患者通常都能快速起效,很多晚期患者在使用NTRK抑制劑後得到了重生,像鉆石一樣罕見又珍貴。
重磅!橫掃21類癌種的「傳奇」抗癌藥拉羅替尼在中國上市!
作為全球首個不分腫瘤來源用於初始治療的靶向藥,拉羅替尼於2018年11月26日被FDA批準上市, 用於成人和小兒具有神經營養受體酪胺酸激酶(NTRK)基因融合的實體瘤治療。
就在2022年4月13日,中國的癌友們苦等了3年多的「傳奇」抗癌藥 拉羅替尼(larotrectinib,硫酸拉羅替尼,商品名:Vitrakvi)終於獲得中國國家藥監局(NMPA)的批準上市 ,用於治療 攜帶NTRK融合基因的實體瘤成人和兒童患者。 這表明,中國癌友們迎來了 全球首款專為NTRK基因融合癌癥患者設計的口服TRK抑制劑。
相關文章:重磅!橫掃21類癌種的「傳奇」抗癌藥拉羅替尼在中國上市!成人兒童均可用!
截止到目前已發現NTRK融合存在於超過 25類癌癥 中,包括 乳癌、結直腸癌、肺癌、甲狀腺癌等,成人和兒童患者都可以使用。
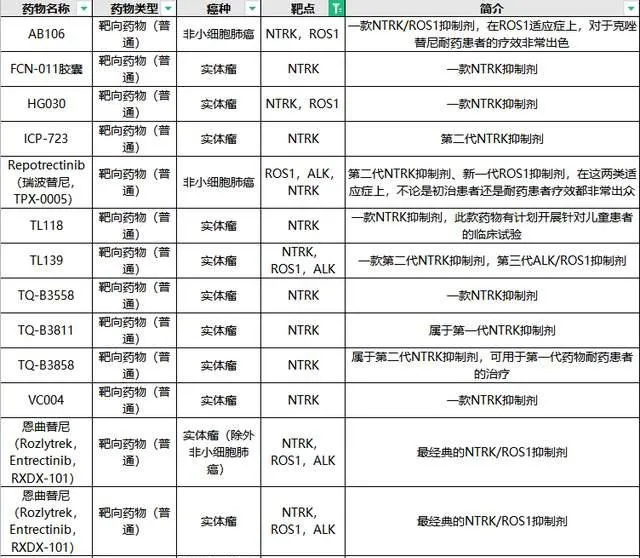
除了拉羅替尼外,目前全球對於NTRK藥物的研發正在如火如荼地進行中,給更多患者帶來新希望!
「釘子戶」靶點——KRAS
KRAS是實體瘤中最常見的癌基因之一,大約30%的腫瘤都存在KRAS突變,包括90%的胰臟癌,30%~40%的結腸癌和15%~20%的肺癌。然而,KRAS靶向藥卻寥寥無幾,KRAS一度成為無藥可用的最難突變。
疾病控制率85.7%,國產靶向藥D-1553首次亮相AACR!
D-1553是由益方生物自主開發的一款新型,高效且口服的KRAS G12C抑制劑。近日,在2022年美國腫瘤研究協會(AACR)年會上,益方生物首次公布了其口服KRAS G12C抑制劑D-1553在癌癥患者中的臨床I期數據,這使得 D-1553成為了首個公布臨床數據的國產KRAS抑制劑。
在一項針對攜帶 KRAS G12C突變的晚期或轉移性實體瘤患者 的國際多中心一期研究中 , D-1553在22例患者中耐受性良好 ,沒有任何劑量限制性毒性。在21例可評估的患者中,觀察到 19.0%確認的腫瘤客觀緩解率 ,達到了 85.7%的疾病控制率 。在劑量水平低至每天300mg時已觀察到腫瘤緩解。
在另一項由上海胸科醫院陸舜教授為主要研究者,針對 攜帶KRAS G12C突變的非小細胞肺癌(NSCLC)患者 的研究分析中包括了59例患者,其中52例為可評估患者, 腫瘤客觀緩解率達到40.4%,疾病控制率高達90.4%。 這些患者均為 晚期或轉移性癌癥患者,大多數已經接受了二線或二線以上的系統性抗癌藥物治療。
數據顯示,在PR2D(600mg/BID,BID為一日兩次)劑量下, D-1553在32例患者中評估的客觀緩解率達到40.6%,疾病控制率為84.4%。 安全性方面,D-1553耐受性良好,未達到劑量限制性毒性。
據悉,D-1553已於2020年10月獲得美國FDA批準在美國、澳洲、中國台灣、南韓等國家和地區啟動了國際多中心I/II期臨床試驗,目前進展順利。並於2021年1月獲得中國國家藥品監督管理局藥品審評中心批準開展 I/II 期臨床試驗。
針對KRAS G12c突變的各類實體瘤患者,D-1553已經正式開始招募患者了!目前急招腸癌、胰臟癌、膽管癌、子宮內膜癌及卵巢癌的KRAS G12C患者。
除了Lumakras、D-1553外,在醫學研究者們不斷地努力之下,KRAS這座堡壘終於破防,多款新藥不斷湧現,並已有多個在研藥物在臨床研究階段取得了早期成功:包括: Adagrasib(MRTX849) 、JNJ-74699157 (ARS-3248)、JAB-3312、LY3499446以及泛KRAS抑制劑BI 1701963等。
相關文章:向最難攻克的KRAS靶點宣戰,國產抗癌藥D-1553首次亮相AACR,劍指晚期實體瘤!
鉆石突變——ALK
對於確定為ALK陽性的患者是幸運的,因為針對ALK的靶向藥有效率超高,副作用不大,一不註意腫瘤就給「吃沒了」。肺癌中的ALK基因融合突變,大約存在於3%~7%的非小細胞肺癌,患者人數並不多。但具有ALK突變的晚期非小細胞肺癌患者,使用ALK抑制劑阿來替尼或克唑替尼,5年生存率都超過了60%。因此, ALK突變也因其罕見但有效的特點被稱為「鉆石突變」。
中國人群肺腺癌ALK融合陽性率為5.1%,而中國EGFR和KRAS均為野生型的腺癌患者中ALK融合基因的陽性率高達30%~42%。 對於非小細胞肺癌來說,年輕、女性、亞裔不吸煙的患者較易出現ALK基因突變。
終於等到了!第三代ALK抑制劑勞拉替尼在中國獲批上市!
2022年4月28日,輝瑞的ALK抑制劑洛拉替尼獲國家藥品監督管理局(NMPA)批準上市,用於治療ALK陽性晚期非小細胞肺癌。這也是國內首款獲批的第三代ALK 抑制劑。
根據勞拉替尼治療中國患者的臨床試驗數據, 僅接受過克唑替尼治療的患者,接受勞拉替尼治療,整體緩解率為70.1%,其中完全緩解率11.9%;基線存在腦轉移的患者 , 顱內病竈的整體緩解率為80.6%,完全緩解率高達52.8%。
而 接受過其它ALK抑制劑 治療的患者,接受勞拉替尼治療的 整體緩解率為47.6%,其中完全緩解率為4.8% ; 基線存在腦轉移的患者 , 顱內病竈整體緩解率為47.6%,其中完全緩解率為28.6%。
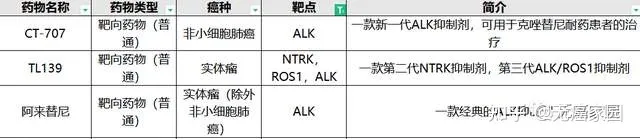
目前無癌家園有多款針對ALK突變的靶向藥(僅展示部份)正在進行臨床研究中!
熱門靶點——FGFR
FGFR基因變異通常在肺癌、肝癌、肝內膽管癌、乳癌、胃癌、子宮癌及尿路上皮癌等實體瘤中廣泛存在,並且不同癌種的FGFR突變類別及頻率也存在差異。
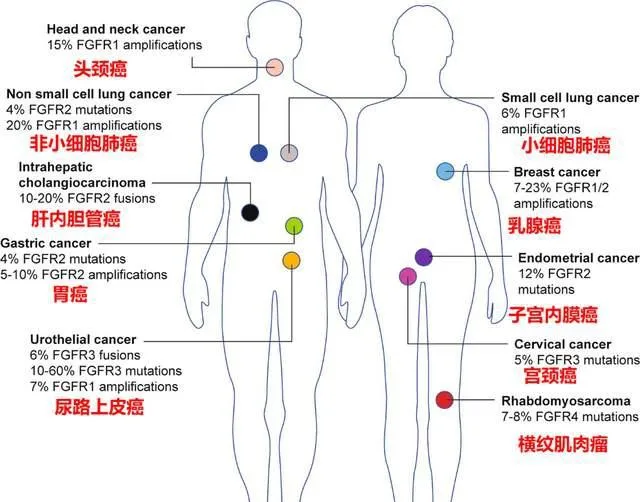
疾病控制率100%!國內膽管癌史上首款靶向藥Pemigatinib閃亮登場!
2022年4月6日,信達生物宣布其引進的 佩米替尼片(Pemigatinib,商品名:達伯坦)在中國獲批上市,用於既往至少接受過一種系統性治療,且經檢測確認存在有FGFR2融合或重排的晚期、轉移性或不可手術切除的膽管癌成人患者的治療。


這則振奮人心的訊息意味著 國內首款獲批上市的FGFR抑制劑終於來了 , 它的上市填補了國內膽管癌靶向治療的空白,也意味著唯化療時代的終結。
與此同時,FGFR靶向藥也逐漸進入到大眾的視野中,對於FGFR靶點,各位癌友們可能比較陌生。但是作為目前「不限癌種」療法的聚焦的熱門靶點之一, FGFR(成纖維細胞生長因子受體) 上市的適應癥主要集中在 膽管癌和尿路上皮癌 上,除此之外,該靶點覆蓋了超過16大癌種,主要包括 肺鱗癌、肝癌、胃癌、乳癌等 多種實體瘤。
目前無癌家園正在招募中的臨床試驗專案中涵蓋了膽管癌、肝癌及胃癌等實體瘤癌種。

小編有話說
近年來由於醫療水平的發展,新型的癌癥治療手段及抗癌新藥相繼出現,其中細胞免疫治療及靶向藥的研發如火如荼地開展,給腫瘤患者帶來了新的希望。
根據最新統計資料顯示,相對於只接受手術、放療、化療的晚期肺癌、胃癌、肝癌等患者來說,輔助細胞免疫療法或采用靶向治療能夠讓患者延長生存期,顯著提高資料效果。
實際上,腫瘤治療其實是一項復雜的「工程」,單純憑借某一種治療手段很難取得良好的效果,腫瘤治療需要綜合各種治療手段相互配合才有可能在抗癌的鬥爭中取得最後的勝利。











