原創 珍奇 圖靈基因 今天
收錄於話題 前沿分子生物學機制
撰文:珍奇
IF:42.78
推薦度:⭐⭐⭐⭐⭐
亮點:
近期,多種證據表明神經元已成為腫瘤微環境的基本細胞成分,且它們的活性可促進多種實體腫瘤的生長,但目前神經元活動對腫瘤啟動的作用尚不明確(特別是在癌癥易感症候群的背景下)。
2021年5月26日,史丹福大學神經病學與神經科學系和華盛頓大學醫學院神經病學系的研究者在
【Nature】
雜誌上共同發表了一篇名為
「NF1 mutation drives neuronal activity-dependent initiation of optic glioma」
的研究論文。他們透過使用由神經纖維瘤病1腫瘤抑制基因(Nf1)突變驅動的視神經膠質瘤(OPG)的小鼠模型,確立了神經元活動在某些類別腦瘤發生發展中的特定作用,闡明了降低OPG發病率或減緩腫瘤進展的治療策略,並強調了Nf1突變介導的神經元訊號通路失調在NF1癌癥易感症候群小鼠模型中的作用。

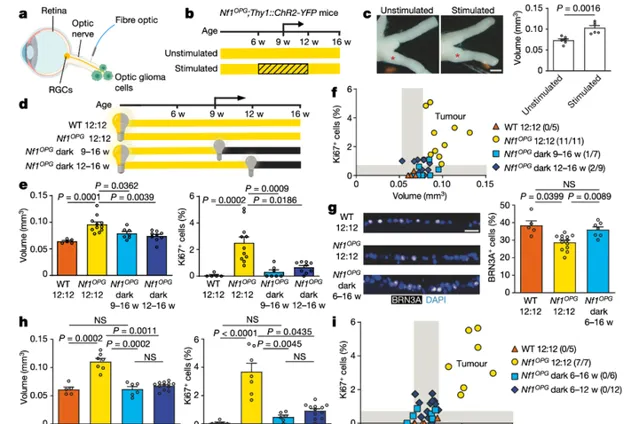
先前研究表明,神經元活動可促進高級別膠質瘤的生長。為了確定神經元活動是否直接促進Nf1驅動的視神經膠質瘤(Nf1-OPGs)的啟動或生長,研究者使用光遺傳學技術刺激了Nf1-OPG 小鼠的單側(右)視神經,其中視紫紅質(ChR2)在 RGCs 中表達。研究結果表明,經光刺激後視神經活動的增加可以促進Nf1-OPG的生長。
為了確定減少視覺體驗(visual experience)對Nf1-OPG 啟動和生長的影響,他們將Nf1OPG小鼠從 9 周齡(腫瘤開始形成時)到 16 周齡時間內持續飼養於黑暗環境下。結果發現,盡管在常規光照周期(12 小時光照和 12 小時黑暗)中生長的所有Nf1OPG小鼠中都出現了腫瘤,但在7 只Nf1OPG小鼠中只有1 只在從 9 至 16 周齡在黑暗中飼養的小鼠含有腫瘤(即視神經體積增加和增殖)。同樣,在 12 至 16 周齡黑暗飼養的 9 只Nf1OPG小鼠中僅檢測到 2 只小鼠出現腫瘤,此時腫瘤已經形成。以上結果證明,在出生後發育的易感時期,視覺體驗對於Nf1-OPGs 的啟動是必要的。
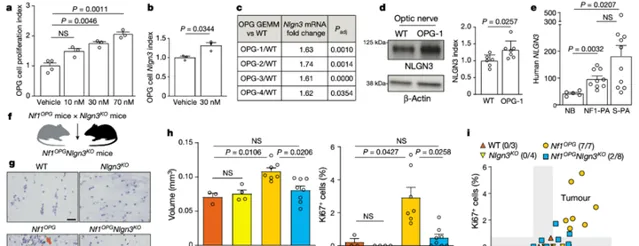
部份皮質神經元活動透過旁分泌機制驅動高級別膠質瘤中的腫瘤生長,相關機制包括神經元活動調節的腦源性神經營養因子(BDNF) 的分泌和突觸粘附蛋白NLGN3的脫落。此外,腫瘤微環境中活性調節的NLGN3 脫落是異種移植模型中高級別膠質瘤進展所必需的,且與患者存活率相關。為了確定BDNF 或NLGN3 是否對低階別膠質瘤的生長也很重要,他們在體外將小鼠視神經膠質瘤細胞暴露於每種旁分泌因子,發現BDNF 和NLGN3 均增加了低階別膠質瘤細胞的增殖。鑒於微環境NLGN3 在高級別膠質瘤的病理生物學中的重要作用,他們接下來關註NLGN3 在Nf1-OPGs 的啟動和維持中的作用。在 Nf1-OPG 和 Nlgn3 基因剔除(Nlgn3KO)小鼠雜交的子代鼠中,他們測試了NLGN3 在Nf1-OPG啟動和維持中的作用。Nf1OPGNlgn3KO小鼠在 16 周齡時表現出基本正常的視神經體積和增殖率,盡管在規則的光照周期中飼養。只有兩只Nf1OPGNlgn3KO小鼠(8 只小鼠中;25%)含有小腫瘤,而Nlgn3 野生型Nf1OPG小鼠中的腫瘤發生率為 100%(7 只中的7 只),由此確立了NLGN3 在促進Nf1-OPG 的啟動和維持。
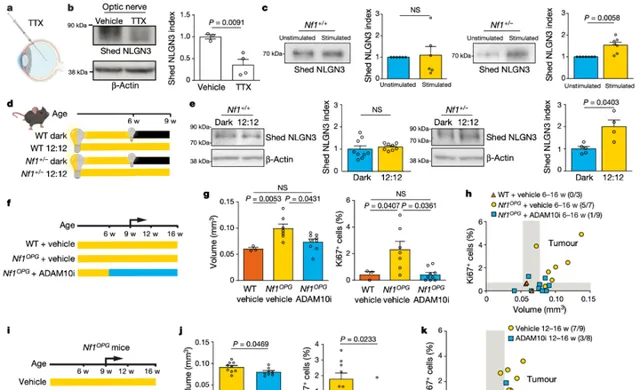
雜合的Nf1突變微環境對於Nf1-OPG的形成是必要的,僅在假定的來源細胞中遺失Nf1的小鼠不會形成腫瘤。小鼠中的Nf1 視神經膠質瘤發生需要將神經祖細胞中的體細胞Nf1 遺失與非腫瘤(基質)細胞中的雜合Nf1 突變相結合,這類似於NF1 癌癥易感症候群患者。這種專性耦合表明Nf1-OPGs的形成取決於Nf1突變對基質細胞相互作用的影響。根據這些觀察結果,他們研究了Nf1突變對活性調節的NLGN3 脫落和NLGN3 驅動的視神經膠質瘤生成的影響。結果表明,NLGN3 脫落受 Nf1+/- 小鼠視神經中的神經元活動調節。且與皮層不同的是,視網膜和視神經在野生型小鼠中幾乎沒有表現出受活動調節的NLGN3脫落,來自 Nf1+/-;Thy1::ChR2 小鼠的視網膜和視神經外植體制備物表現出響應光刺激的NLGN3脫落增加,且在規則光周期中升高的 Nf1+/-小鼠的視神經中脫落的NLGN3 水平增加。由此說明,Nf1 突變異常增加了視神經中神經元活動調節的NLGN3 脫落。
NLGN3 的胞外域被ADAM10 蛋白酶以活性依賴性方式從少突膠質細胞前體細胞和神經元的細胞表面切割並釋放,而ADAM10 主要由神經元分泌。光刺激的視網膜和視神經外植體的ADAM10 分泌僅在 Nf1+/-;Thy1::ChR2 中增加,而在 Nf1+/+;Thy1::ChR2小鼠中沒有增加,這說明了Nf1 的假設突變誘導的視神經中活性調節的NLGN3 脫落增加可能來自少突膠質前體細胞,是透過從 Nf1 +/- RGC 神經元分泌ADAM10 增加介導的。但 Nf1 突變如何使ADAM10 的分泌失調仍然是一個懸而未決的問題。此外,在12 至 16 周齡(Nf1-OPG 已經形成的時期)用GI254023X 治療的 8 只(37.5%)Nf1OPG小鼠中只有 3 只表現出小腫瘤。這些結果表明視神經活動調節的NLGN3 脫落對於Nf1-OPGs 的形成和維持至關重要,在未來這將是一個有希望的治療靶點。
本實驗首次證明了雜合Nf1 突變與環境刺激(光)相互作用以控制腫瘤形成。未來的研究將需要確定這種相互作用是否反映了Nf1 突變對 RGC 興奮性的影響。與精準醫學相關,NF1患者中存在許多種系NF1突變,這些突變與神經膠質瘤的風險不同,並可能對神經元與神經膠質瘤的相互作用產生不同的影響。在抑制Nf1OPG小鼠中ADAM10 後腫瘤形成的消除則意味著ADAM10-NLGN3軸在未來可作為治療NF1 兒童時期出現的視神經膠質瘤的潛在靶點。
教授介紹:

Michelle Monje
,史丹福大學神經病學及神經科學系副教授。
Monje
實驗室主要研究出生後神經發育的分子和細胞機制。這包括在正常神經發育和疾病狀態下,微環境對神經前體細胞命運選擇的影響。重點領域包括神經膠質瘤發生的神經指令、細胞對神經源性和膠質源性訊號微環境的貢獻、神經前體細胞命運的分子決定因素以及神經前體細胞在腫瘤發生和修復機制中的作用。作為一名執業神經學家和神經腫瘤學家,
Monje
博士對神經前體細胞功能和功能障礙在兒童腦腫瘤起源和癌癥治療後果中的作用特別感興趣,因此他們也一直在關註腦幹腫瘤,及其空間和時間特異性表明潛在的發育原因。
參考文獻:
Pan, Y., Hysinger, J.D.,Barron, T. et al. NF1 mutation drives neuronal activity-dependentinitiation of optic glioma. Nature (2021).https://
doi.org/10.1038/s41586-
021-03580-6











