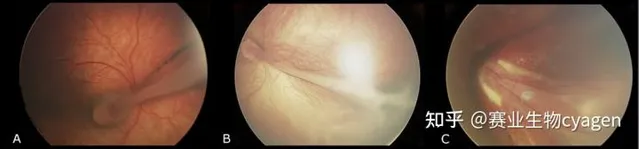
上期每周一鼠我們講到遺傳性視網膜疾病(IRD),本期講述的是另一個眼部組織罕見病—— 家族性滲出性玻璃體視網膜病變(FEVR) 。
家族性滲出性玻璃體視網膜病變(FEVR)是一組罕見的遺傳性視網膜疾病,其特征是異常的視網膜血管生成,導致周圍視網膜血管化不完全,隨後出現視網膜缺血 。FEVR的無血管視網膜導致缺氧和新生血管生長刺激進入玻璃體,從而導致後期的玻璃體視網膜牽拉、黃斑下滲出和出血、視網膜褶皺、牽拉性視網膜脫離和黃斑移位。FEVR的臨床表現往往不對稱,在同一家庭的受影響成員之間也會有顯著差異。輕度疾病患者可能無癥狀,而重度疾病患者可能表現為嚴重的視力喪失。目前尚無特效藥物可用於治療FEVR,但激光治療、玻璃體切割手術等方法可以幫助緩解癥狀和保護視力[1]。
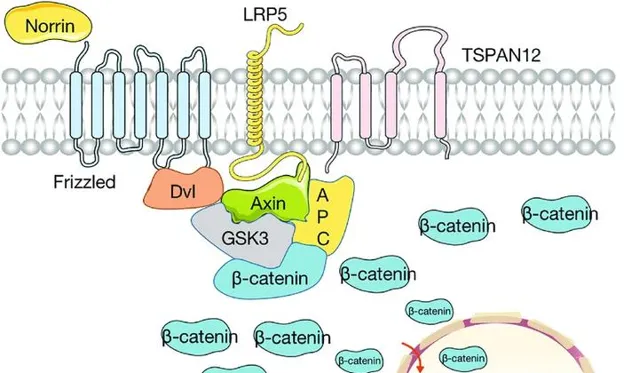
血管發育受多種訊號通路精密調控,其中Wnt訊號通路是關鍵調控系統之一。Norrin/β-Catenin訊號通路是一種重要的Wnt訊號傳導途徑,它在眼睛和耳朵的血管發育中起著核心作用[3]。在這條通路中,主要是透過Norrin與其受體FZD4、LRP5和TSPAN12結合形成復合物來實作調節作用,從而促進視網膜血管生成。 目前已知至少有9個基因的突變會導致FEVR,包括NDP,FZD4,LRP5,TSPAN12,ZNF408,KIF11,RCBTB1,CTNNB1和JAG1,占全球所有FEVR病例的約50%。 這些基因突變會影響Wnt訊號通路的正常調節作用,導致視網膜血管生成異常和視網膜缺血等癥狀[4]。
01
NDP相關FEVR
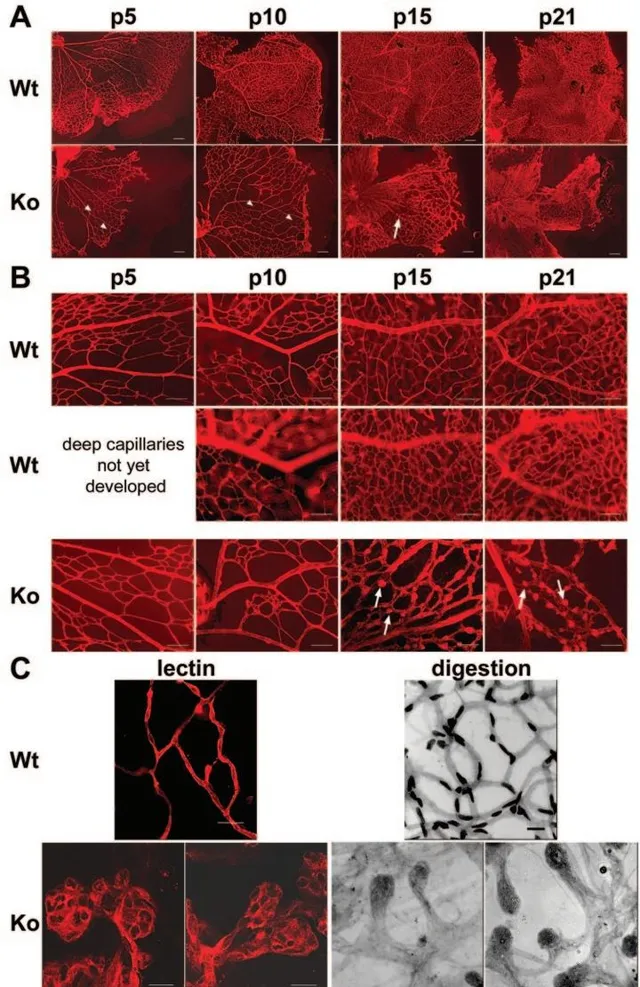
NDP基因編碼Norrin蛋白,該蛋白與視網膜血管的生長和發育有關。Norrin蛋白與FZD4蛋白結合,形成高親和力的配體-受體對,並與輔助組分TSPAN12一起,透過促進β-Catenin進入細胞核,誘導FZD4和LRP5依賴性啟用經典Wnt通路。Wnt訊號通路在眼睛的生長和發育中起著重要作用,其缺陷會影響這一過程,並在FEVR和Norrie疾病的病理過程中起著重要作用[5]。因此,NDP基因突變會影響Norrin蛋白的功能,從而影響Wnt訊號通路,導致FEVR的發生。 在小鼠中,Ndp基因的敲除將導致淺層視網膜血管發育延遲,並且無法形成深層視網膜血管,進一步會形成類似微動脈瘤的病變,這是典型的視網膜血管缺陷表型[6]。
02
FZD4相關FEVR
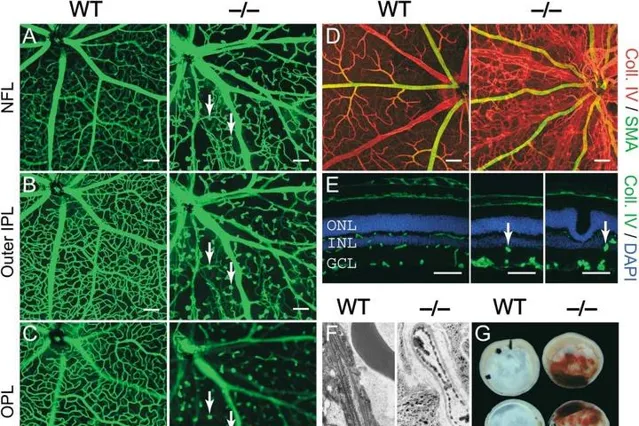
FZD4作為Wnt訊號通路的受體,可透過結合Wnt蛋白來啟用該通路,並促進視網膜血管的正常發育。FZD4突變導致其無法與Wnt蛋白結合,從而導致Wnt訊號通路的抑制,這種異常會導致靜脈瘤的形成和視網膜缺血等癥狀。此外,FZD4基因突變也可能透過影響TGF-β訊號通路和Notch訊號通路等其他訊號通路的調節,從而影響視網膜血管的發育和維護。以上兩種機制可能共同導致了FEVR的發生或惡化[7]。與Ndp敲除小鼠表型相似, Fzd4-KO小鼠的視網膜和內耳的血管發育受到了極大的影響並且出現視網膜應激的表型。 Fz4的缺失導致多個表型的出現,包括視網膜表面內皮細胞遷移的延緩,視網膜內的二級和三級血管分枝的消除,玻璃體血管系統程式性退化的極大延遲,並在耳蝸血管內產生漸進性擴大和退化以及小腦血管的漸進性紊亂等。此外,Fz4缺失可能還會導致其他非血管方面的表型,如腦部退化和聽力障礙[8]。
03
TSPAN12相關FEVR
TSPAN12基因編碼的跨膜蛋白同樣也是Wnt訊號通路中的一個重要成員,TSPAN12可以與FZD4共同作用,參與Wnt訊號通路的調節,促進視網膜血管的正常發育。TSPAN12的突變與FZD4突變導致的表型較為相似,都導致靜脈瘤的形成和視網膜缺血等癥狀,並透過影響VEGF和Notch等訊號通路,來影響視網膜血管的發育和維護[9]。同樣, Tspan12基因剔除小鼠擁有和Fzd4敲除小鼠相似的表型,包括靜脈瘤的形成、血管分支和血管消退的異常等視網膜內血管發育異常 。此外, Tspan12缺失還會導致小鼠出現視力障礙、視網膜缺血以及心臟異常、肝臟異常和骨骼畸形等其他器官和組織的發育異常[10]。
04
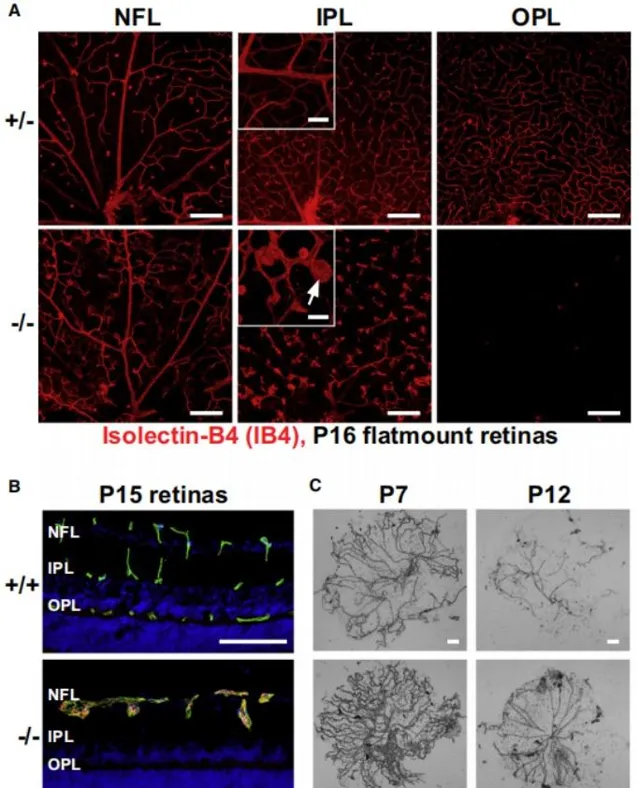
LRP5相關FEVR
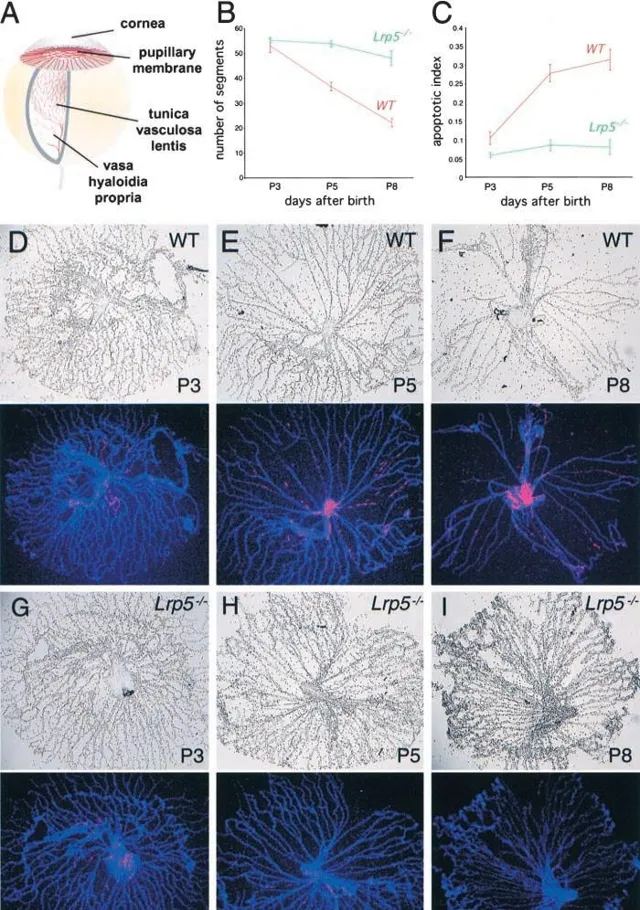
LRP5作為Wnt訊號通路的受體,可以透過結合Wnt蛋白來啟用Norrin/β-Catenin訊號通路,參與視網膜血管形成的調控。LRP5基因的功能缺失型導致其無法與Wnt蛋白結合,造成Wnt訊號通路異常,導致視網膜血管的異常發育,包括靜脈瘤的形成和視網膜缺血等癥狀,最終導致FEVR的發生。此外,LRP5也參與調控骨密度和膽固醇代謝途徑的調節,LRP5基因的功能喪失突變會也導致骨質疏松-假瘤症候群(OPPG)。相反,LRP5的功能增強突變會導致異常骨密度增高[11]。 因此LRP基因剔除小鼠除表現為視網膜血管異常和視網膜發育不良等眼部疾病表型外,還呈現骨骼畸形和低骨密度等骨骼表型以及膽固醇代謝異常和高膽固醇血癥等心血管表型[12-14]。與Ndp和Fzd4基因剔除小鼠相比,Lrp5-KO小鼠的視網膜病變視網膜更溫和,且出現骨骼畸形和代謝失常等非視網膜血管表型。
05
CTNNB1相關FEVR
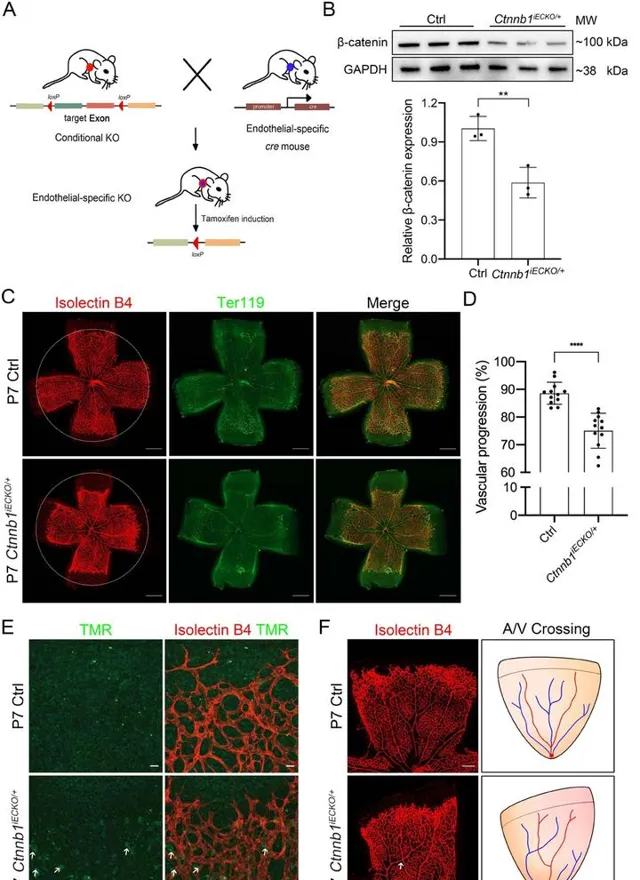
CTNNB1基因編碼的β-catenin蛋白是一種粘著連線蛋白,它與鈣粘蛋白、α-catenin共同組成粘附連線復合體,透過調控細胞生長以及細胞間的粘附,在上皮細胞層的構建與維持中起著重要作用。通常認為,CTNNB1基因的缺失會導致CTNNB1症候群,這是一種嚴重的神經發育障礙。最近的研究發現CTNNB1基因的某些功能缺失突變也會導致伴痙攣性肌癱和視力缺陷(NEDSDV)和家族性滲出性玻璃體視網膜病變(FEVR)等視網膜缺陷疾疾病[15-16]。在小鼠中的研究表明,Ctnnb1基因全身性敲除的會導致胚胎期死亡、胚胎發育異常、神經管缺陷、肝臟發育異常、腎臟發育異常和心臟發育異常等嚴重表型的出現,但鮮有視網膜表型報道。最近的一項研究發現內皮細胞特異性Ctnnb1敲除會降低Norrin/β-catenin通路的活性,從而影響視網膜血管生成。 在該小鼠模型中,視網膜血管生成受到抑制,表現出FEVR樣表型[17],此外,編碼α-catenin的Ctnna1基因的內皮細胞特異性缺失同樣呈現除與Ctnnb1缺失小鼠類似的FEVR樣表型,也可用於該疾病的研究[18]。
06
KIF11相關FEVR
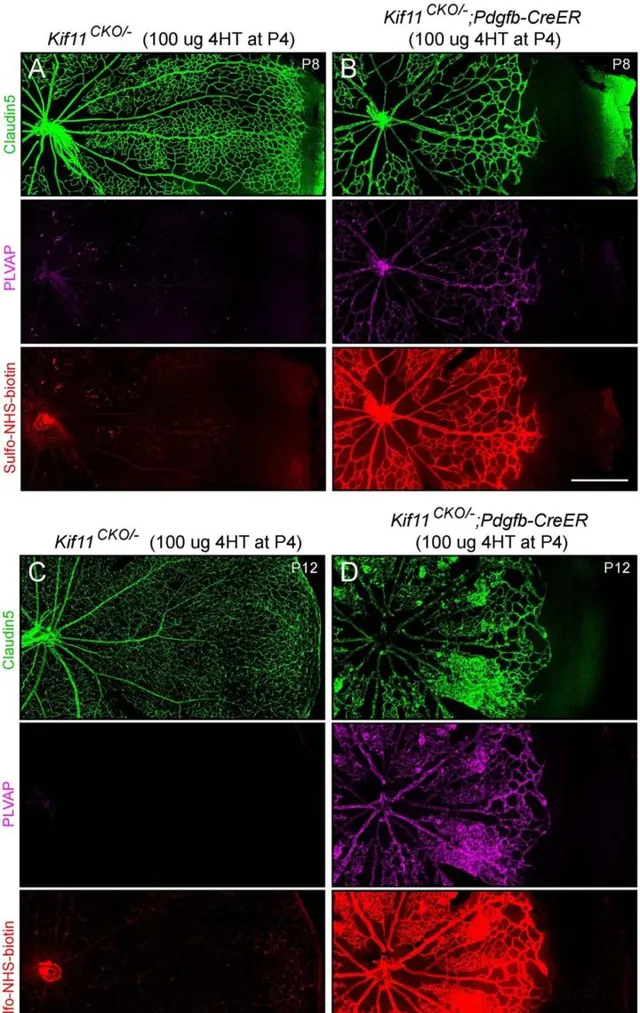
KIF11是獨立於Norrin/β-Catenin訊號通路的另一個重要的FEVR致病基因,該基因編碼的馬達蛋白參與了細胞分裂和微管動力學等生物學過程。KIF11也是視網膜母細胞中的一個重要因子,能夠調節微管動力學並參與視網膜血管的生長和分支。在人類中,KIF11的失活突變與伴或不伴小頭畸形的視網膜血管低下和以淋巴水腫,脈絡膜視網膜發育不良,小頭畸形和/或智力低下的不同組合為特征的多器官症候群有關。研究表明,一些FEVR患者體內KIF11的突變可能影響其視網膜血管的發育和穩定,但具體機制未知。因此,Kif11基因剔除小鼠模型已被用來研究KIF11基因突變與FEVR之間的關系。 最近的一項研究表明內皮細胞特異性Kif11敲除會導致小鼠視網膜血管系統嚴重發育遲緩和小腦脈管系統輕度發育遲緩[19]。內皮細胞Kif11-cKO小鼠的表型與內皮細胞Ctnnb1-cKO小鼠非常相似,進一步證明KIF11缺失與FEVR之間的密切聯系。
參考文獻:
[1]「Familial Exudative Vitreoretinopathy (FEVR).」 EyeWiki. American Academy of Ophthalmology, 6 July 2023. https:// eyewiki.aao.org/Familia l_Exudative_Vitreoretinopathy_(FEVR) .
[2]Ranchod TM, Ho LY, Drenser KA, Capone A Jr, Trese MT. Clinical presentation of familial exudative vitreoretinopathy. Ophthalmology. 2011 Oct;118(10):2070-5.
[3]Xiao H, Tong Y, Zhu Y, Peng M. Familial Exudative Vitreoretinopathy-Related Disease-Causing Genes and Norrin/β-Catenin Signal Pathway: Structure, Function, and Mutation Spectrums. J Ophthalmol. 2019 Nov 16;2019:5782536.
[4]Wang X, Chen J, Xiong H, Yu X. Genotype-phenotype associations in familial exudative vitreoretinopathy: A systematic review and meta-analysis on more than 3200 individuals. PLoS One. 2022 Jul 13;17(7):e0271326.
[5]Jia LY, Ma K. Novel Norrie disease gene mutations in Chinese patients with familial exudative vitreoretinopathy. BMC Ophthalmol. 2021 Feb 15;21(1):84.
[6]Luhmann UF, Lin J, Acar N, Lammel S, Feil S, Grimm C, Seeliger MW, Hammes HP, Berger W. Role of the Norrie disease pseudoglioma gene in sprouting angiogenesis during development of the retinal vasculature. Invest Ophthalmol Vis Sci. 2005 Sep;46(9):3372-82.
[7]Huang L, Lu J, Zhang L, Zhang Z, Sun L, Li S, Zhang T, Chen L, Cao L, Ding X. Whole-Gene Deletions of FZD4 Cause Familial Exudative Vitreoretinopathy. Genes (Basel). 2021 Jun 27;12(7):980.
[8]Xu Q, Wang Y, Dabdoub A, Smallwood PM, Williams J, Woods C, Kelley MW, Jiang L, Tasman W, Zhang K, Nathans J. Vascular development in the retina and inner ear: control by Norrin and Frizzled-4, a high-affinity ligand-receptor pair. Cell. 2004 Mar 19;116(6):883-95.
[9]Lai MB, Zhang C, Shi J, Johnson V, Khandan L, McVey J, Klymkowsky MW, Chen Z, Junge HJ. TSPAN12 Is a Norrin Co-receptor that Amplifies Frizzled4 Ligand Selectivity and Signaling. Cell Rep. 2017 Jun 27;19(13):2809-2822.
[10]Junge HJ, Yang S, Burton JB, Paes K, Shu X, French DM, Costa M, Rice DS, Ye W. TSPAN12 regulates retinal vascular development by promoting Norrin- but not Wnt-induced FZD4/beta-catenin signaling. Cell. 2009 Oct 16;139(2):299-311
[11]Norwitz NG, Mota AS, Misra M, Ackerman KE. LRP5, Bone Density, and Mechanical Stress: A Case Report and Literature Review. Front Endocrinol (Lausanne). 2019 Mar 26;10:184.
[12]Gong Y, Slee RB, Fukai N, Rawadi G, Roman-Roman S, Reginato AM, Wang H, Cundy T, Glorieux FH, Lev D, Zacharin M, Oexle K, Marcelino J, Suwairi W, Heeger S, Sabatakos G, Apte S, Adkins WN, Allgrove J, Arslan-Kirchner M, Batch JA, Beighton P, Black GC, Boles RG, Boon LM, Borrone C, Brunner HG, Carle GF, Dallapiccola B, De Paepe A, Floege B, Halfhide ML, Hall B, Hennekam RC, Hirose T, Jans A, Jüppner H, Kim CA, Keppler-Noreuil K, Kohlschuetter A, LaCombe D, Lambert M, Lemyre E, Letteboer T, Peltonen L, Ramesar RS, Romanengo M, Somer H, Steichen-Gersdorf E, Steinmann B, Sullivan B, Superti-Furga A, Swoboda W, van den Boogaard MJ, Van Hul W, Vikkula M, Votruba M, Zabel B, Garcia T, Baron R, Olsen BR, Warman ML; Osteoporosis-Pseudoglioma Syndrome Collaborative Group. LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell. 2001 Nov 16;107(4):513-23.
[13]Kato M, Patel MS, Levasseur R, Lobov I, Chang BH, Glass DA 2nd, Hartmann C, Li L, Hwang TH, Brayton CF, Lang RA, Karsenty G, Chan L. Cbfa1-independent decrease in osteoblast proliferation, osteopenia, and persistent embryonic eye vascularization in mice deficient in Lrp5, a Wnt coreceptor. J Cell Biol. 2002 Apr 15;157(2):303-14.
[14]Kim SP, Frey JL, Li Z, Goh BC, Riddle RC. Lack of Lrp5 Signaling in Osteoblasts Sensitizes Male Mice to Diet-Induced Disturbances in Glucose Metabolism. Endocrinology. 2017 Nov 1;158(11):3805-3816.
[15]Li N, Xu Y, Li G, Yu T, Yao RE, Wang X, Wang J. Exome sequencing identifies a de novo mutation of CTNNB1 gene in a patient mainly presented with retinal detachment, lens and vitreous opacities, microcephaly, and developmental delay: Case report and literature review. Medicine (Baltimore). 2017 May;96(20):e6914.
[16]Panagiotou ES, Sanjurjo Soriano C, Poulter JA, Lord EC, Dzulova D, Kondo H, Hiyoshi A, Chung BH, Chu YW, Lai CHY, Tafoya ME, Karjosukarso D, Collin RWJ, Topping J, Downey LM, Ali M, Inglehearn CF, Toomes C. Defects in the Cell Signaling Mediator β-Catenin Cause the Retinal Vascular Condition FEVR. Am J Hum Genet. 2017 Jun 1;100(6):960-968.
[17]He Y, Yang M, Zhao R, Peng L, Dai E, Huang L, Zhao P, Li S, Yang Z. Novel truncating variants in CTNNB1 cause familial exudative vitreoretinopathy. J Med Genet. 2023 Feb;60(2):174-182.
[18]L, Huang Y, Fei P, Yang Y, Zhang S, Xu H, Yuan Y, Zhang X, Zhu X, Ma S, Hao F, Sundaresan P, Zhu W, Yang Z. Catenin α 1 mutations cause familial exudative vitreoretinopathy by overactivating Norrin/β-catenin signaling. J Clin Invest. 2021 Mar 15;131(6):e139869.
[19]Wang Y, Smallwood PM, Williams J, Nathans J. A mouse model for kinesin family member 11 (Kif11)-associated familial exudative vitreoretinopathy. Hum Mol Genet. 2020 May 8;29(7):1121-1131.
如果你也對各類動物實驗/細胞與基因治療CRO及技術服務感興趣,那就快快關註我們的知乎帳號:賽業生物cyagen吧!幹貨高頻分享,總有你需要的
還可以關註我們的微信公眾號:賽業生物訂閱號,針對多類目內容設定了多項趣味專欄,媽媽再也不用擔心我找不到資料啦!現在添加小助理微信:cyagen- class,還可以進入交流群共同學習 點贊、推薦、麽麽噠











