表皮生長因子受體(EGFR)作為非小細胞肺癌(NSCLC)中最早發現的驅動基因,可謂真正改變了非小細胞肺癌的治療格局。表皮生長因子受體-酪胺酸激酶抑制劑(EGFR-TKI)以其高精度和高特異性,實作了「療效好」和「副反應小」的雙贏。
目前,已有三代EGFR-TKI用於臨床,包括第一代的吉非替尼、厄洛替尼等,第二代的阿法替尼、達可替尼,第三代的奧希替尼等。
但幾乎所有的靶向藥物,都面臨著巨大的挑戰:耐藥。即便是「神藥」奧希替尼,也難以避免。科學家們不斷探索研究耐藥機制,希望能夠改變靶向藥物耐藥的局面。
終於,在機制探索過程中,他們發現代謝重編程是正常細胞發生惡性轉化的重要特點,可能是靶向藥耐藥的一大機制。近期,科學家們發現了一個新的逆轉EGFR-TKI耐藥的靶點——醛糖還原酶(AKR1B1)。癌度和大家一起分享這一最新研究成果。
醛糖還原酶:多代EGFR-TKI耐藥的潛在靶點
醛糖還原酶是做什麽的呢?當血糖正常時,這種酶不會被啟用。然而,在高血糖的環境下,醛糖還原酶就會被啟用,將葡萄糖轉化為山梨醇,而山梨醇不易透過細胞膜,會在細胞內蓄積,使細胞膜的通透性發生改變,導致細胞代謝與功能的損害。因此,糖尿病病人常常需要使用醛糖還原酶抑制劑來降低這種酶的活性。
醛糖還原酶和EGFR-TKI耐藥有什麽關系呢?首先,科學家發現醛糖還原酶表達與非小細胞肺癌耐藥相關(圖1A)。進一步探索發現,無論是厄洛替尼耐藥(ER),吉非替尼耐藥(GR)還是奧希替尼耐藥(OR)的細胞,醛糖還原酶的表達量均明顯升高;而且OR細胞醛糖還原酶表達相對更高(圖1B)。這些初步結果提示,醛糖還原酶 是多代EGFR-TKI耐藥的潛在靶點 。
 圖1.AKR1B1與EGFR-TKI耐藥相關
圖1.AKR1B1與EGFR-TKI耐藥相關
醛糖還原酶為什麽與多代EGFR-TKI耐藥有關呢?隨後,科學家進行了深層機制的探索。 EGFR-TKI耐藥細胞存在一個奇怪的現象,那就是「谷胱甘肽從頭合成」這一細胞代謝明顯旺盛了起來 (圖2)。

圖2.谷胱甘肽從頭合成影響EGFR-TKI耐藥
敏銳的科學家自然想到,這一代謝是否能和醛糖還原酶這個優選靶點聯系起來呢?於是,他們采用一些技術幹擾了EGFR-TKI耐藥細胞中醛糖還原酶的表達,觀察谷胱甘肽合成的量是否變化。結果發現, 醛糖還原酶表達的抑制,會明顯減少谷胱甘肽合成 (圖3)。進一步研究,科學家發現,醛糖還原酶高表達,透過活化細胞增殖相關的STAT3通路,來促進谷胱甘肽從頭合成過程,最終誘導了EGFR-TKI耐藥。
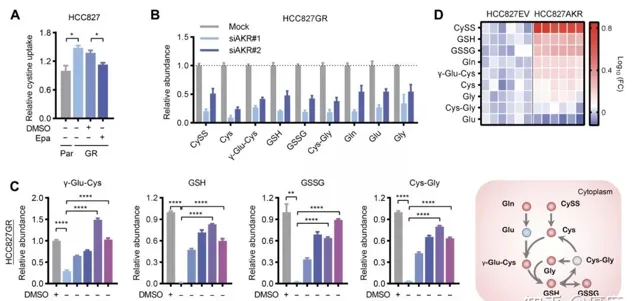 圖3.耐藥細胞中AKR1B1表達控制谷胱甘肽從頭合成過程
圖3.耐藥細胞中AKR1B1表達控制谷胱甘肽從頭合成過程
降糖藥依帕司他抑制醛糖還原酶表達,逆轉EGFR-TKI耐藥
機制清楚了,是否能透過抑制醛糖還原酶來逆轉EGFR-TKI耐藥,延長EGFR-TKI作用時間呢?這才是我們最為關心的問題。他們想到了依帕司他,這是一種常用的降糖藥,同時也是醛糖還原酶的抑制劑。也就是說, 常用降糖藥依帕司他能抑制醛糖還原酶表達。如果能證實依帕司他能逆轉EGFR-TKI耐藥,臨床就有可及的廉價藥了! 在早期現象觀察中,科學家在EGFR-TKI耐藥細胞中加入了依帕司他,結果令人驚喜—腫瘤細胞的生長增殖活性被有效抑制了(圖4)。
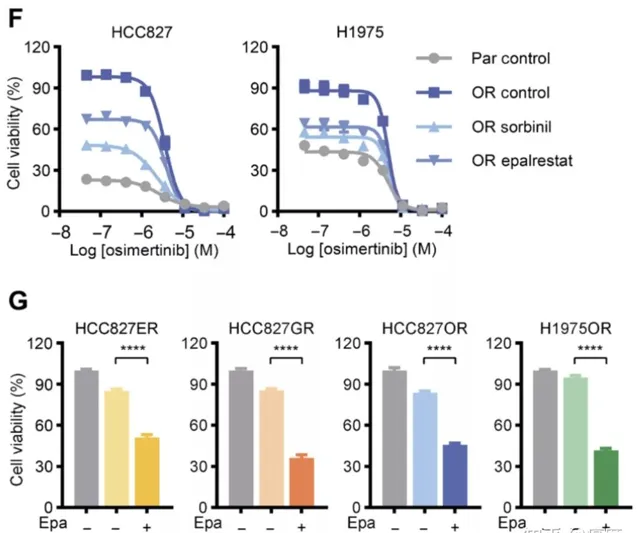 圖4.依帕司他有效抑制EGFR-TKI耐藥腫瘤細胞的活性
圖4.依帕司他有效抑制EGFR-TKI耐藥腫瘤細胞的活性
克服重重研究困難後,科學家開始了體內實驗研究,這是比單純細胞層面的結果更為可靠的實驗。他們將耐藥細胞接種到小鼠體內,觀察醛糖還原酶抑制劑依帕司他,以及依帕司他聯合奧希替尼,對腫瘤生長的抑制效果。
結果顯示, 無論是腫瘤細胞來源的小鼠模型,還是人腫瘤來源的小鼠模型(PDX),依帕司他均能有效延長奧希替尼的治療效果和有效時間(圖5A~E)。將依帕司他與奧希替尼聯合套用時,腫瘤體積縮小非常明顯,幾乎所有腫瘤的治療療效都能達到部份緩解(PR),這其中80%病竈幾乎消失,達到了完全緩解(CR) (圖5F)。免疫組化染色進一步顯示,醛糖還原酶導致EGFR-TKI耐藥過程中的關鍵分子,STAT3和SLC7A11得到了有效的抑制(圖5G),這從機制層面證實了醛糖還原酶抑制對EGFR-TKI耐藥的逆轉。
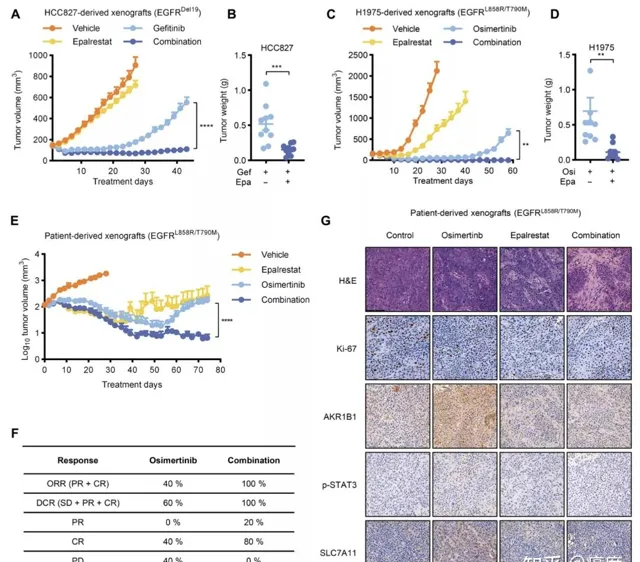 圖5.體內實驗驗證依帕司他透過抑制AKR1B1活性達到逆轉EGFR-TKI耐藥效果
圖5.體內實驗驗證依帕司他透過抑制AKR1B1活性達到逆轉EGFR-TKI耐藥效果
小結與啟示
一種常用的降糖藥依帕司他,能有效逆轉EGFR-TKI的獲得性耐藥發生,這就是這項研究的臨床潛在意義。透過檢測醛糖還原酶表達情況,對醛糖還原酶高表達的EGFR突變患者加用這一常見的降糖治療藥物,或許能很好地提高EGFR-TKI的抗腫瘤作用,並延長EGFR-TKI的起效持續時間。當然,這還是一項初期的基礎研究,依帕司他的臨床效果如何,如何設定醛糖還原酶高表達臨界值以篩選最佳獲益人群等等問題,我們還要期待後續的臨床試驗。
這項研究從代謝角度,解釋了EGFR-TKI獲得性耐藥的機制和應對策略,豐富了腫瘤靶向治療耐藥機制研究的內涵。相信快速的研究進展,將逐步從多個方面、多個角度闡述靶向治療的耐藥機制,為臨床腫瘤患者的個體化治療提供更加精準的藍圖。











