這篇回答,沒有方法技巧!沒有高考題!沒有易錯點!沒有考向預測!
只有最最最最最基礎的高考化學知識。化學基礎差的同學看這裏就夠了!
基礎知識+回歸課本
基礎知識包括:
1、常見物質俗名 2、常見物質顏色 3、常見實驗現象
4、考試中經常用到的規律 5、「10電子」、「18電子」的微粒小結
6、具有漂白作用的物質 7、各種「氣」匯集
8、滴加順序不同,現象不同的實驗 9、原電池 10、等效平衡問題及解題思路
11、常見物質分離提純的10種方法 12、常用的去除雜質的方法10種
13、化學實驗基本操作中的「不」15例
14、中學化學中與「0」有關的實驗問題4例 15、特殊試劑的存放和取用10例
16、能夠做噴泉實驗的氣體 16、最最基礎的化學方程式66個
回歸課本包括:
必修1化學反應和化學方程式式
必修2常見物質的顏色、物質的俗名和化學式
選修3 物質結構與性質(含必修1部份內容)
選修4 化學反應原理
選修5 有機化學基礎
考點歸納
——————我是分割線——————
基礎知識
1、常見物質俗名
無機部份:
純堿、蘇打、天然堿 、口堿:Na2CO3 小蘇打:NaHCO3 大蘇打:Na2S2O3
石膏(生石膏):CaSO4.2pO 熟石膏:2CaSO4·.pO 瑩石:CaF2
重晶石:BaSO4(無毒) 碳銨:NpHCO3 石灰石、大理石:CaCO3
生石灰:CaO 食鹽:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7pO (緩瀉劑)
燒堿、火堿、苛性鈉:NaOH 綠礬:FeSO4·7pO 幹冰:CO2 明礬:KAl (SO4)2·12pO
漂白粉:Ca (ClO)2 、CaCl2(混和物) 瀉鹽:MgSO4·7pO 膽礬、藍礬:CuSO4·5pO
雙氧水:pO2 皓礬:ZnSO4·7pO 矽石、石英:SiO2 剛玉:Al2O3
水玻璃、泡花堿、礦物膠:Na2SiO3 鐵紅、鐵礦:Fe2O3 磁鐵礦:Fe3O4
黃鐵礦、硫鐵礦:FeS2 銅綠、孔雀石:Cu2 (OH)2CO3 菱鐵礦:FeCO3 赤銅礦:Cu2O
波爾多液:Ca (OH)2和CuSO4 石硫合劑:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
過磷酸鈣(主要成分):Ca (pPO4)2和CaSO4 重過磷酸鈣(主要成分):Ca (pPO4)2 天然氣、沼氣、坑氣(主要成分):Cp 水煤氣:CO和p
光化學煙霧:NO2在光照下產生的一種有毒氣體 王水:濃HNO3與濃HCl按體積比1:3混合而成。
鋁熱劑:Al + Fe2O3或其它氧化物。 尿素:CO(Np) 2
有機部份:
氯仿:CHCl3 電石:CaC2 電石氣:C2p (乙炔) TNT:三硝基甲苯 酒精、乙醇:C2pOH
氟氯烴:是良好的制冷劑,有毒,但破壞O3層。 醋酸:冰醋酸、食醋 CpCOOH
裂解氣成分(石油裂化):烯烴、烷烴、炔烴、pS、CO2、CO等。 甘油、丙三醇 :C3H8O3
焦爐氣成分(煤幹餾):p、Cp、乙烯、CO等。 石炭酸:苯酚 蟻醛:甲醛 HCHO
福爾馬林:35%—40%的甲醛水溶液 蟻酸:甲酸 HCOOH
葡萄糖:C6p2O6 果糖:C6p2O6 蔗糖:C12p2O11 麥芽糖:C12p2O11 澱粉:(C6p0O5)n
硬脂酸:C17p5COOH 油酸:C17p3COOH 軟脂酸:C15p1COOH
草酸:乙二酸 HOOC—COOH 使藍墨水褪色,強酸性,受熱分解成CO2和水,使KMnO4酸性溶液褪色。
2、常見物質顏色
鐵:鐵粉是黑色的;一整塊的固體鐵是銀白色的。 Fe2+——淺綠色 Fe3O4——黑色晶體
Fe(OH)2——白色沈澱 Fe3+——黃色 Fe (OH)3——紅褐色沈澱 Fe (SCN)3——血紅色溶液
FeO——黑色的粉末 Fe (Np)2(SO4)2——淡藍綠色 Fe2O3——紅棕色粉末 FeS——黑色固體
銅:單質是紫紅色 Cu2+——藍色 CuO——黑色 Cu2O——紅色 CuSO4(無水)—白色 CuSO4·5pO——藍色 Cu2 (OH)2CO3 —綠色 Cu(OH)2——藍色 [Cu(Np)4]SO4——深藍色溶液
BaSO4 、BaCO3 、Ag2CO3 、CaCO3 、AgCl 、 Mg (OH)2 、三溴苯酚均是白色沈澱
Al(OH)3 白色絮狀沈澱 pSiO4(原矽酸)白色膠狀沈澱
Cl2、氯水——黃綠色 F2——淡黃綠色氣體 Br2——深紅棕色液體 I2——紫黑色固體
HF、HCl、HBr、HI均為無色氣體,在空氣中均形成白霧
CCl4——無色的液體,密度大於水,與水不互溶 KMnO4--——紫色 MnO4-——紫色
Na2O2—淡黃色固體 Ag3PO4—黃色沈澱 S—黃色固體 AgBr—淺黃色沈澱
AgI—黃色沈澱 O3—淡藍色氣體 SO2—無色,有剌激性氣味、有毒的氣體
SO3—無色固體(沸點44.8 0C) 品紅溶液——紅色 氫氟酸:HF——腐蝕玻璃
N2O4、NO——無色氣體 NO2——紅棕色氣體 Np——無色、有剌激性氣味氣體














——————分割線我又來了——————
回歸課本
必修一
1. P4 常見危險化學品的標誌,主要知道常見物質的性質與標誌相對應。
如酒精為易燃液體、高錳酸鉀為氧化劑、濃硫酸為腐蝕品、KCN為劇毒品。如P10習題第二題選B。
2. P6-7 熟記過濾、蒸發、蒸餾裝置圖,分別需要哪些儀器?
蒸餾燒瓶中溫度計水銀球的位置,冷凝管水流方向(若冷凝管豎直冷凝水流方向)。蒸餾燒瓶和普通燒瓶的區別。
3. P7 除去粗鹽中的Ca2+、Mg2+、SO42-等雜質,先加入過量的BaCl2,至沈澱不再產生後,再加入過量的Na2CO3、NaOH,充分反應後將沈澱一並濾去,經檢測發現濾液中仍含有一定量的SO42-,其原因是BaSO4和BaCO3的Ksp差不大,當溶液中存在大量的CO32-時,BaSO4就會部份轉化為BaCO3。其中Na2CO3的作用是:除Ca2+和過量的Ba2+。所以試劑加入順序Na2CO3在之BaCl2後。
4. P9 萃取和分液:
分液裝置圖,分液漏鬥的結構(兩活塞、兩小孔)。溴水呈橙色、溴的(苯)CCl4橙紅色。碘水呈黃色,碘的(苯)CCl4呈紫紅色。萃取後分液,上下層液體分別從上下口倒出。註意實驗1-4的第(2)步、(4)步操
作的註意事項及規範的文字表述。P9關於CCl4的註解①
5.P10 第6-7題
氯離子、CO32-和SO42-的檢驗方法。
6.P16 配制一定物量濃度的溶液()
重點註意步驟、圖示、註解、註意事項(包括P18習題6)、學與問等。稱量固體時托盤天平只保留一位,量筒量取液體時也只保留一位。
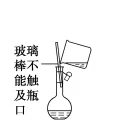
容量瓶使用的第一步操作:檢查是否漏水(簡稱「查漏」)。「查漏」的方法:向容量瓶中加入適量水,蓋好瓶塞,左手食指頂住瓶塞,右手托住瓶底,將容量瓶倒轉過來看瓶口處是否有水滲出,若沒有,將容量瓶正立,將瓶塞旋轉180度,重復上述操作,如果瓶口處仍無水滲出,則此容量瓶不漏水。若漏水,可以在瓶塞處塗凡士林。常見容量瓶的規格有50 mL、100 mL、250 mL、500 mL、1000 mL 幾種。如配制溶液時明確知道所需容量瓶規格,則需將容量瓶規格一並答上。如圖所示:用玻璃棒引流時,玻璃棒末端應插入到刻度線以下,且玻璃棒靠近容量瓶口處且不能接觸瓶口。定容時,膠頭滴管不能伸入容量瓶。配制一定物量濃度的溶液所需要的實驗儀器:托盤天平、量筒、玻璃棒、容量瓶(容量一定要指明)、膠頭滴管、燒杯、藥匙。重要的實驗步驟:計算→稱量(量取)→溶解(稀釋)→轉移(輕搖)→定容→搖勻→倒出裝瓶。定容時視線與凹液面最低處相平,直到液面與刻度線相切。
7. P26-27
認真閱讀科學探求、科學史話、膠體的定義、膠體的性質、Fe(OH)3膠體制備 、區別膠體和溶液的方法等知識:FeCl3溶液呈棕黃色,制備Fe(OH)3膠體的操作方法是:在沸水中滴加飽和FeCl3溶液,繼續煮沸至紅褐色,停止加熱。將0.1mol FeCl3制成膠體,所得的膠粒數小於0.1NA,Fe(OH)3膠體不帶電,Fe(OH)3膠粒帶正電。 FeCl3溶液和Fe(OH)3膠體最本質的區別是膠體粒子大小在1nm-100nm之間,區別
我承認我懶了,直接放圖













以上這些吃透,你的基礎要是還差,我把它們打印出來全吃了












