qRT-PCR(实时荧光定量PCR)是RNAi的标准检测方法,今天小优就以一个siRNA沉默mRNA的案例来展示如何进行计算吧~
RNAi实验的步骤
本案例采用实时一步RT-PCR分析CDC2基因敲除情况。流程如下:
步骤1: siRNA转染 - HeLa S3细胞转染靶向人类CDC2基因的0.5 nM siRNA、阴性siRNA对照(与任何已知的哺乳动物基因没有同源性的非沉默对照siRNA)。并添加未转染细胞作为对照。
步骤2: RNA纯化 ——48小时孵育后,收集细胞,使用试剂盒纯化RNA。
步骤3:使用以上RNA为模板进行qRT-PCR。使用一步法q RT-PCR试剂盒,(逆转录反应和扩增在同一试管中进行)。进行CDC2和GAPDH(一种管家内源性参考基因)的基因特异性定量。

qRT-PCR还需要注意以下内容:
(1)无模板对照NTC:这是一个无模板RNA,可用ddpO补足,包含扩增反应的所有成分。NTC可以检测到qRT-PCR反应组分中可能存在的任何污染。
(2)内源性内参基因的标准化:内源内参基因是指表达水平在样本之间不存在差异的基因。将目的基因与内源性内参基因进行比较,可纠正RNA含量的变化和样本处理中的其他差异。在本实验中,使用管家基因GAPDH进行归一化。
(3)来自未转染细胞的模板:对未转染对照的分析显示,在没有任何处理的情况下,基因表达水平。
(4)来自阴性siRNA对照的模板:将转染阴性siRNA对照的细胞中的靶基因表达与转染基因特异性siRNA后的基因表达进行比较,计算基因敲除率。
未转染对照组的基因表达水平应与转染阴性siRNA对照组观察到的水平进行比较。二者基因表达应该是相似。这两个样本之间的任何基因表达差异都是由非特异性效应引起的。
(5)每个样本至少重复2次。重复实验对于解释样本间的变化很重要,以确保数据是可靠和稳健的。至少应进行2次重复实验,重复之间的差异应较低。为了确保变异是可接受的低水平,计算变异系数(%Cv=(标准偏差(重复)/平均CT(重复))x100)。这一点应该始终低于3%。
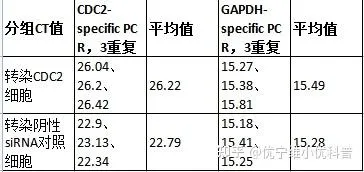
步骤4:结果分析:获取到可信的CT值,进行计算。本实验数据如下:
使用∆∆CT方法计算siRNA沉默效率,计算公式如下:
靶基因表达=2-∆∆CT
∆CT (样本) = CT 靶基因– CT内参基因
∆CT (对照) = CT 靶基因 – CT内参基因
∆∆CT = ∆CT (样本) – ∆CT (对照)
本实验数据带入公式计算: ∆CT(样本) = 26.22 – 15.49 = 10.73
∆CT (对照) = 22.79 – 15.28 = 7.51
∆∆CT= 10.73 – 7.51 = 3.22
样本中靶基因表达= 2-3.22 = 0.107,CDC2 siRNA对样本的沉默效率为:100%-10.7% = 89.3%。
一般来说,下调70%或以上被认为是显著高的。然而,根据细胞类型、靶基因和下游检测的不同,较低的敲低水平可能也就足以用于RNAi研究。
其他的基因调控实验,如miRNA mimic,cDNA等均可以使用同样的方法进行计算。
小优推荐:
往期文献阅读推荐
#1.siRNA——你不知道的那些小奥秘
#2.为什么你的siRNA结果不被认可
#3.如何快速启动siRNA文库筛选
#4.从培养细胞到qRT-PCR,QIAGEN一步反应试剂盒助力快速基因检测!
#5.qPCR这件「小」事儿
以上文章可直接进公众号「优宁维分子生物学」进行搜索查看











