脂肪的内容比较杂,我觉得分成不同的独立文章来介绍,会脉络清晰一些。这是第二篇。
朋友昊哥,很爱健身,也很好学,前两天跟我聊起脂肪细胞。
「丸子,网上很多文章都说,人在青春期后,脂肪细胞数量固定不会少,也有人说,脂肪细胞一出生就固定了,我总觉得不合理,但是他们都说这是真的,你给说说。」
昊哥感觉这个话题有点不合理,其实是因为这个知识点符合传说中的网络谣传定律之一——太绝对。到底对不对呢?
「丸子,生活中我们常常见到一些朋友,吃饭的时候总是满头大汗,汗流浃背,热一点的天气里,就更加严重,简直汗如雨下。这是为什么呢?」
你说我又不是医生,他怎么会问我这个问题呢?好吧,一个健身者,对正常人体的认识,未必比医生差。这问题嘛……
——————
脂肪组织主要由大量群集的脂肪细胞构成,聚集成团的脂肪细胞由薄层疏松结缔组织分隔成小叶。网络脂肪细胞的网状纤维非常发达(细胞间胶原物质)。
脂肪组织的主要特征是可以大量储存脂肪,然后它们还有其他重要作用。
比如,某类脂肪组织还能高速产热,比肌肉还快。
再比如,脂肪组织能够以自分泌、旁分泌和远距分泌方式产生生物活性因子或因子样分子(激素或类激素),称为脂肪因子。它们影响胰岛素敏感性、血压水平、内皮功能、纤溶活动及炎症反应,参与多种重要病理生理过程。
脂肪细胞的分类
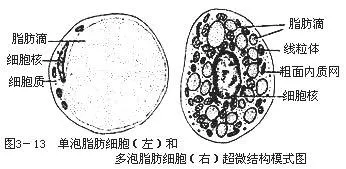
脂肪细胞按结构可以分有两类,单泡脂肪细胞和多泡脂肪组织。单泡脂肪细胞,细胞中央有一大脂滴,胞质呈薄层,位于细胞周缘,包绕脂滴、核扁,在边缘,细胞呈空泡状。多泡脂肪组织的细胞核在中心位置,外围包裹很多颗脂滴,线粒体大而丰富。
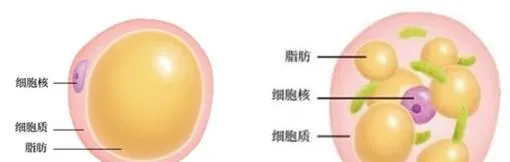
脂肪细胞按功能,可以分为白色脂肪组织(也称黄色脂肪细胞)、褐色脂肪组织(也称棕色脂肪组织)和米色脂肪组织(也称浅棕色脂肪细胞)三个大类。
皮下脂肪、内脏脂肪,都属于白色脂肪。白色脂肪细胞是人体的主要脂肪细胞,占所有脂肪细胞数量的90%以上。
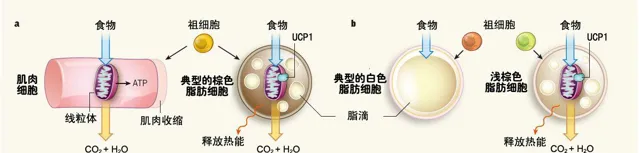
褐色脂肪组织的外观呈褐色,细胞内含有大量的脂肪小滴及高浓度的线粒体,细胞间含有丰富的毛细血管和大量的交感神经纤维末梢。褐色脂肪组织具有高效的产热效应,是机体在面对身体环境变化时的主要紧急温度调节系统。
褐色脂肪细胞跟肌肉细胞来源于一种表达(myf5)的前体细胞。
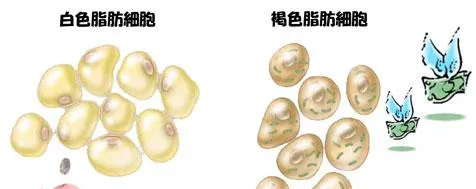
米色脂肪组织,零散分布在皮下的白色脂肪组织中间,它可以在受到刺激——长期寒冷环境、运动或长期的β肾上腺素作用后,转化成褐色细胞。由于这种细胞从发育来源,分子生物学、形态和功能上来讲,都有其特殊性,因此,它是另一类特殊的脂肪细胞。
脂肪细胞的存储
脂肪细胞组织是人体最大的储能组织。人体约有250亿~400亿个脂肪细胞(可以大概地说约有300亿个),某些肥胖者体内脂肪总数超过900亿个脂肪细胞。通常脂肪组织中80%为脂肪,2%为蛋白质,18%为水分。
脂肪在人体内的储存量很大(世界有记录的最胖者体重是445公斤)。当脂肪细胞储存甘油三酯时,体积可以膨胀2-4倍。
脂肪细胞多分布在腹腔、皮下、肌纤维间,但其分布的比例差异较大。
一个80公斤体重,体脂15%的男性,在平常非消化时段中,其脂肪组织内约有12公斤脂肪(约有8公斤在皮下,4公斤在腹腔内),在肌肉组织中,约有300克肌内酯,在血浆中,约有4克甘油三酯和0.4克游离脂肪酸。
脂肪细胞平均有10年的寿命,它们中储存的甘油三酯会被以旧换新,代谢6次——旧的脂肪被氧化分解,排出细胞,新的脂肪再次形成继续储存。
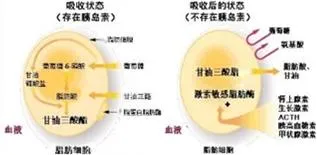
脂肪细胞的能量代谢机理很简单,主要是吸收存储能量和释放能量两种状态。
脂肪细胞在胰岛素的作用下,吸收甘油三酯、葡萄糖,合成并储存为脂肪。脂肪细胞在一种或多种激素(肾上腺素、生长激素、胰高血糖素、甲状腺素等)影响下,释放其储存的脂肪。
假如过多的能量不能留在脂肪细胞,那这些过多的脂肪酸就会外溢到其它地方,这就是脂肪异位沉积。
脂肪细胞数量到底变不变
脂肪细胞的数量一直都是个变数,每时每刻,都有旧的脂肪细胞死亡,新的脂肪细胞生成,对正常人而言,上半身脂肪细胞数量通常保持相对稳定,下半身随肥胖加重而增加脂肪细胞的数量。
但对于肥胖者,情况就大为不同。
以往认为,人体内脂肪细胞的数量,从青春期以后基本上是保持固定不变,造成肥胖的原因,主要与体内脂肪细胞体积增大有关。
这个结论依据于:「有研究追踪几个月内增重15%-25%的男性,发现即使体重猛增也不会增加脂肪细胞数目。」(Sims,E.A.等人,人类的肥胖实验,1968年,153页-70)
但 后来的研究发现,当肥胖者体重超过标准体重的 70%时,患者体内不仅有脂肪细胞肥大的表现,而且还往往伴有脂肪细胞数量的增加,即体内同时有新的脂肪细胞生成。
进一步的研究发现,体内脂肪如果过量积累,使已有的脂肪细胞膨胀到极限,
体积最大可以扩大约3倍(某些人极限可达4倍),满载,人体就会使脂肪细胞数增多,以保障机体的正常代谢平衡。肥胖者往往拥有远超正常人甚至五倍以上数量的脂肪细胞。
2010年Tchoukalova进一步的研究证明,对于普通成年人,上下半身的脂肪增加机制不同。 下半身在脂肪增加期间,增加脂肪细胞的数量,上半身的脂肪增长则增加脂肪细胞的体积 。之前关于脂肪细胞的很多结论,都是基于测量上半身脂肪细胞而得出。
因此,肥胖和脂肪细胞数量与大小两者增加都可能有关——如果你够胖的话。
减重时,脂肪细胞的数量并不会减少,而是脂肪细胞的大小会先缩小。所以短期体重下降,随后如果很快地就恢复超量的饮食,那么体积缩小的脂肪又会很有效率地吸收脂肪,恢复原来的体重。
褐色脂肪组织
褐色脂肪组织(BAT细胞)最早是在1551年由Gesner在土拨鼠体内发现的。1912年Polimsnti提出,BAT可能具有物质交换和热能调节的作用。
BAT细胞与我们传统的脂肪细胞认识有很大的不同,它虽然也储存脂肪,但它主要的功能,还是产热,快速发热,快速耗能。
BAT细胞的产热能力是肝脏的60倍,是肌肉在有氧呼吸下产热量的10倍。
人体内的褐色脂肪很少,在生长发育过程中在不断变化,婴幼儿期所占比例较高,随着年龄的增长,体内褐色脂肪量逐渐减少。
成年人体内褐色脂肪的重量一般都低于体重的2%(80公斤体重的正常人,褐色脂肪重量通常低于1.6公斤)。
褐色脂肪主要分布在颈后,背侧一带(锁骨上区、颈部、后纵隔、腹膜后间隙及肠系膜)。在肩胛下、肩胛间、肾周围、胸部、腋下、肋间、主动脉周围、心脏周围、腹股沟和脊柱背部等区域也有分布。

日常生活中,我们在遭遇寒冷时打寒战,就是机体在调用BAT细胞产热。我们在吃饭时,感觉全身发热,胖的人,甚至会在进食时汗流浃背,也是BAT细胞在通过产热耗能来耗散一些过剩能量。
为产热而生的独特设计
BAT细胞能如此高效产热,跟其独特的结构有关。
【 丰富的供氧结构 】褐色脂肪组织周围有丰富的毛细血管,它的每个细胞都直接与毛细血管接触,并受无髓交感神经末梢支配。丰富的血红蛋白与其他细胞色素共同作用也造就了它的褐色。丰富的毛细血管,为旺盛的代谢提供了充足的氧气供给。
【 敏锐的外部环境感知 】BAT的每个细胞几乎都接受棒状的神经末梢支配,因此对外界的环境条件变化反应更敏感、更迅速。
【 科学的能量储备分布 】BAT的细胞呈多边形,较小。胞质中央一般具圆形核,周围密布着小脂肪滴,故又称「多空泡性脂肪组织」,这种结构,能够在能量调用时,有最好的效果。
【 先进的大锅炉 】BAT细胞还富含线粒体,其体积大,内膜面积也因众多的嵴而更大扩展。
交感神经与激素对 BAT的控制
BAT的产热活动受中枢神经系统,如下丘脑神经核团的控制,外周则受交感神经的直接支配。
当动物受到与产热有关的刺激时,下丘脑中枢主要通过β肾上腺能通路把产热指令传给BAT,支配 BAT的交感神经末梢释放去甲肾上腺素(NE)(细节如下图),随后在去甲肾上腺素和甲状腺素共同作用下,促进BAT细胞产热。
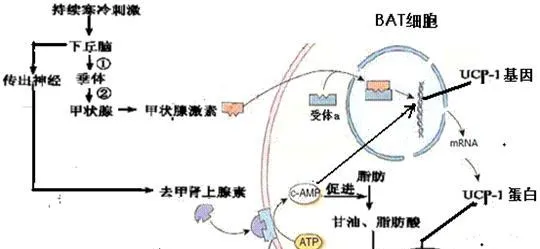
BAT的产热除受完整的交感神经支配外,还受复杂的内分泌因子,如甲状腺激素、肾上腺激素、胰岛素、胰高血糖素、生长激素、性激素、褪黑激素和催乳素等的调节,并受生理状况及其交互作用的影响。
影响 BAT组织功能活性的其他因素
【 年龄和发育阶段 】新生哺乳动物的BAT发达,代谢活跃,而成年哺乳动物有完善的体温调节能力,故其 BAT的非颤抖性产热能力不发达。
【 摄食的成份和个体大小 】长期富营养的动物,其BAT产热成倍增加,此为食物诱导产热,使大量过剩的能量以热的形式耗散掉。
【 低代谢或负能量阶段 】禁食、妊娠和哺乳期的动物,其BAT功能低下。相反如高代谢状态,BAT功能增加。
【 光周期 】短日照可刺激BAT的非颤抖产热能力增加,BAT的呼吸速率增加,从而导致动物的耐寒性增加。
另外,遗传背景、疾病外伤等等因素,也可能影响到BAT的活动状态。
总之,人体通过对环境冷暖各方面可能变化的感知,推动BAT组织的活跃或静默。从而调节人体的温度或维持人体的总能量储备在一定的范围内。
米色脂肪细胞
米色脂肪细胞具有白色和褐色脂肪细胞的功能,并能在两者之间转换。
当未受到刺激时,米色脂肪细胞与白色脂肪类似,为单泡脂肪细胞,细胞内线粒体水平很低,其主要作用是储存脂肪。
当在寒冷的刺激下或运动后,机体交感神经兴奋,米色脂肪组织的形态学及生物学特征发生改变,细胞内出现很多散布的小脂肪滴,线粒体水平及氧化磷酸化效率升高,而且其呼吸容量比典型褐色脂肪高,其作用主要是适应性生热。
米色脂肪细胞的生热机理跟褐色脂肪细胞不同。运动后肌细胞内PGC1-α合成增加,PGC1-α刺激细胞内FNDC5基因表达。FNDC5是一种分泌性的膜蛋白,分泌出鸢尾素(irisin)。鸢尾素分泌入血后随血液循环作用于皮下的米色脂肪,使米色脂肪转换形态,从白色脂肪细胞形态转换为褐色脂肪细胞形态——小脂滴散布,线粒体水平升高,耗氧量增加,大量生热。
脂肪组织的激素效应
1994年,脂肪激素——瘦素的发现,使人们认识到,脂肪组织并不仅仅是储备脂肪的场所,还是一个主动参与能量代谢的内分泌器官。
随后的研究证实,脂肪细胞能分泌很多被称为脂肪细胞因子的活性物质,在维持能量及心血管的内环境稳定,葡萄糖及脂类代谢,免疫应答等方面发挥着重要作用,并且与肥胖、糖尿病及其并发症有着紧密的联系。
公认的脂肪细胞分泌因子可分为两类:一类是脂肪组织特异表达的脂肪细胞分泌因子,如瘦素、内脂素、抵抗素和脂联素等;另一类是脂肪组织非特异表达的脂肪细胞分泌因子(就是其他机体组织也可以分泌),如肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)等。
这些脂肪细胞分泌因子通过自分泌或旁分泌作用,与分布于器官和组织中的相应受体结合,将脂肪细胞组织变成一个重要的内分泌组织和免疫及炎性调节组织。
瘦素
瘦素是由白色脂肪组织分泌的一种激素。白色脂肪组织受胰岛素刺激分泌瘦素,胰腺β细胞受瘦素影响减少胰岛素分泌。这样的联动效应,可以使胰岛素保持在一定的水平范围内。
当然,瘦素不仅仅控制胰岛素的分泌,他主要作用于下丘脑的代谢控制中枢,调节机体的能量代谢和控制脂肪的积累(①抑制食欲,减少能量摄取;②增加能量的消耗;③抑制脂肪合成;④促进脂肪分解)。瘦素还参与调节单核细胞、巨噬细胞和淋巴细胞的免疫功能,是一种作用广泛的细胞因子。
脂联素
脂肪细胞分泌的脂联素不仅参与糖和脂肪的代谢调节(降低脂肪合成,抑制葡萄糖向脂肪转化,促进机体利用脂肪供能的作用),还具有增加胰岛素的敏感性和抗动脉粥样硬化作用。
脂肪细胞的脂肪含量与脂联素的分泌成反比,即脂肪细胞的脂肪含量越高,血液中的脂联素水平就越低,患上糖尿病的风险相对增加。
内脂素
由内脏脂肪组织分泌,主要促进脂肪组织合成。内脂素与糖脂代谢关系密切,具有胰岛素模拟功能(与胰岛素的功能相似),并且与炎症及血管病理生理都有相关性。
抵抗素
抵抗素也是一种脂肪细胞分泌的特异因子,它在人体中的作用主要有以下四项。
酰化刺激蛋白
酰化刺激蛋白一方面能够提高脂肪细胞捕获脂肪酸和合成甘油三酯的能力;另一方面可以通过抑制激素敏感脂酶的活性来抑制甘油三酯的分解。
肿瘤坏死因子
脂肪组织释放的肿瘤坏死因子(TNF-α,1993年发现脂肪细胞也分泌),其作用比较复杂,参与脂肪代谢直接相关的主要有以下数项。
① 可促进脂肪分解,②降低脂蛋白酯酶(LPL)的生成和活性,③抑制脂肪细胞对脂肪酸的摄入,④减少脂肪细胞生成,⑤促进脂肪的分解,⑥抑制前脂肪细胞分化为成熟脂肪细胞,⑦诱导促进脂肪细胞凋亡,⑧控制脂肪细胞的分化和脂肪组织体积的扩大。
TNF-α还能降低脂肪生成关键酶(如乙酰CoA羧化酶、脂肪酸合成酶等)的表达;TNF-α也能负性调控脂肪细胞和肌细胞中的葡萄糖转运蛋白(GLUT-4),导致细胞内葡萄糖摄取量的减少。
白细胞介素 6
白细胞介素6(IL-6,1997年发现脂肪细胞可分泌),除了在机体免疫和炎性反应方面具有显著作用外,长期高剂量的IL-6可直接刺激脂肪细胞的脂肪分解。
视黄醇结合蛋白 4
在脂肪细胞分泌的众多蛋白中,视黄醇结合蛋白4(RBP4)是预测内脏脂肪含量最强的因子。
随着脂肪细胞的分化成熟,RBP4逐渐分泌增多,机体内脏脂肪含量的变化都可以从RBP4含量的变化体现出来。
在肝脏中, RBP4诱导磷酸烯醇式丙酮酸羧化酶表达,增加肝糖原输出,使血糖升高。血清RBP4升高减少肌肉中葡萄糖摄取。
在脂肪组织中,RBP4通过抑制葡萄糖转运蛋白(GLUT4)的表达,抑制脂肪细胞对葡萄糖的摄取 。
其他因子
脂肪细胞还分泌一些其他因子,如C反应蛋白、胰岛素样生长因子1(IGF-1)等等。
总之,今天的脂肪组织,已经跟往日不同,它存脂肪,分泌激素,调节免疫和炎症。关于它的知识,还在不断更新。
明天,我们会更加清楚的认识它。对于如何驾驭它,也会有更多的筹码和办法。
——————
「丸子,说好的膳食搭配呢?」
……
我先写一些基础营养知识,再聊搭配比较好,不要着急。
————
脂肪细胞数量部分参考文献:
1,Pool, Robert. Fat: fighting the obesity epidemic. Oxford [Oxfordshire]: Oxford University Press. 2001. ISBN 0-19-511853-7.
2,Faust, IM.; Johnson, PR; Stern, JR; Hirsch, J (1978). "Diet-induced adipocyte number increase in adult rats: a new model of obesity". Am J Physiol 235 (3): 279–96. PMID 696822.
3,Tchoukalova, YD.; Votruba, SB; Tchkonia, T.; Giorgadze, N.; Kirkland, JL.; Jensen, MD. (2010). "Regional differences in cellular mechanisms of adipose tissue gain with overfeeding". PNAS 107 (42): 18226–31. doi:10.1073/pnas.1005259107. PMC 2964201. PMID 20921416.
4,Tchoukalova YD, et al. Subcutaneous adipocyte size and body fat distribution. Am J Clin Nutr. 2008;87:56–63.
5,Tchoukalova Y, Koutsari C, Jensen M. Committed subcutaneous preadipocytes are reduced in human obesity. Diabetologia. 2007;50:151–157.
6,Drolet R, et al. Hypertrophy and hyperplasia of abdominal adipose tissues in women. Int J Obes (Lond) 2008;32:283–291.











