DNA是细胞遗传物质的重要载体,基因组复制是所有生物维持遗传性状和生理活动的必备过程。复制程序调控如果出现问题,会直接威胁基因组稳定性,是涉及人类衰老以及癌症等诸多重大疾病的重要因素
【1】
。DNA复制程序的调控主要依赖于复制起始位点和启动时间的选择,即DNA复制从哪里开始,以及每个起始位点何时开始复制。通俗地说,可以将全基因组想象成一个国家的铁路系统,DNA复制起始位点和复制时间就好比该国境内的所有始发站及发车时间,必须很好的协调。然而对于复制起始位点的研究一直是该领域的难点,存在很大争议
【2】
。这主要是由于缺乏有效的一致认可的研究复制起点的高通量技术。因为DNA复制程序,即使对于同种细胞系的不同单个细胞来说,也存在细胞间复制起始位点的高度差异,并且绝大部分起始位点的复制效率都非常低(只在1-10%的细胞中使用),这导致复制起始位点的准确检测异常困难。
因而如何高效准确地识别复制起点的位置,成为揭示细胞复制机制的关键,是目前学科的前沿和热点。
2021年6月21日,法国居里研究所
陈春龙
教授、美国麻省医学院
Nick Rhind
教授、弗罗里达州立大学
David M. Gilbert
教授 和 加拿大西蒙菲莎大学
John Bechhoefer
教授在
Molecular Cell
上联合发表标题为
Genome-Wide Mapping of Human DNA Replication by Optical Replication Mapping Supports a Stochastic Model of Eukaryotic Replication
的研究论文。作者
通过Bionano高通量单分子成像技术,将包含荧光标记的复制起点和复制叉轨迹的超长DNA分子(150 kb – 2 Mb,平均长度~300 kb)匹配到人类基因组上,发现了除已知的复制起始位点外的大量新位点组成的复制起始区域。

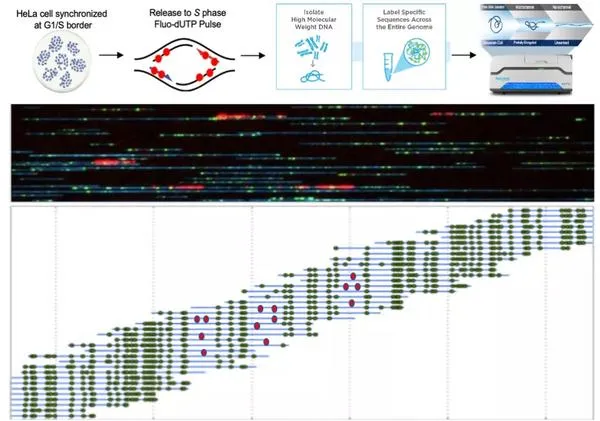
图1. Optical Replication Mapping(ORM)技术通过高通量单分子成像鉴定复制起始位
Bionano单分子成像是一种全新的基因组光学图谱技术。Bionano通过全基因组中特定序列(例如限制性内切酶酶切位点)处的荧光基团标记,然后基于纳米微流控芯片技术通过DNA分子在纳米通道(nanochannel)上的运动获得超长线性单分子(上百kb),最后通过高分辨率显微镜成像读取这些单分子的信息。通过DNA分子上绿色信号的相对坐标,检查到的分子可以很容易的匹配到参考序列上,如图1所示。该技术拥有高通量,低成本,单分子,超长读长和高匹配准确度等优势,已广泛应用于基因组的组装,基因组结构变异的检测等领域。
该工作是首次将Bionano技术应用拓展至人类细胞DNA复制领域,作者通过获得覆盖率高达整个人类基因组长度的1700倍的单分子数据,能发现使用品频率低至千分之一的复制起始位点
。同时, 作者发现绝大部分在细胞复制早期检测到的复制起始位点位于早复制区(一种评估该位点在众多细胞中平均复制时序被称为Replication Timing - RT的物理量
【3】
),但仍有部分检查到的起始位点位于晚复制区域。这打破了传统学说的严格复制时序调控理论,说明了即使在晚复制(细胞群体的平均值)区域中,部分细胞依然可能在此区域选择起始位点,在S phase的早期复制。
作者通过对细胞进入S期后的不同时间结点的细胞进行分析,根据所检测到的复制起始位点附近标记的DNA复制标记片段的分布,可以清楚地观测到随着S phase的推进,DNA复制从复制起始位的向两边推进的渐变过程,这说明了该技术以及其所识别的复制起点的准确性。同时,除了鉴定复制起始位点,
本研究方法还能检测复制叉在S期的动态变化。
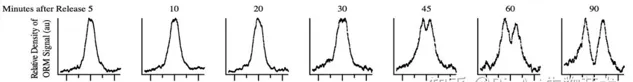
图2. 随着细胞复制的推进,ORM技术检测到的复制信号从复制起始位点向上下游延伸
通过进一步的多组学数据分析,作者发现复制起始区域主要富集于基因组上开放的组蛋白区域,尤其是高表达基因的间隔区。特别是在复制起始区域,揭示了各种可能与复制相关的蛋白例如
pAZ
【4】
(协助DNA复制复合物的加载和起始过程)以及其它开放区域相关的组蛋白信号例如
DNAse I,pK4me1
等(常富集于基因表达的增强子或启动子等区域)的富集。而基因转录过程相关的蛋白信号例如pK79me2,RNA Pol II- phosphoS2等则在复制起始区域的上下游富集。这些结果与该课题组之前发表的通过测量细胞群体水平的Okazaki fragments(OK-seq)
【5】
获得的复制起始区的研究结果相吻合。
复制起点富集于基因间隔区很可能是为了避免复制过程与转录过程的冲突【6】
。这进一步为ORM技术所发现的复制起始位点的可靠性提供了强有力的生物学佐证。
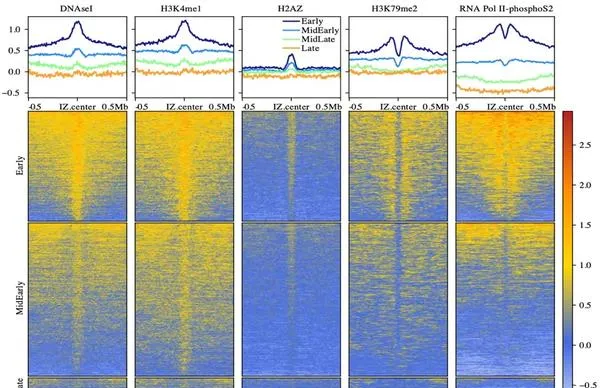
图3. 代表性分子蛋白信号在复制起点区域附近的的富集情况
由于本方法的单分子水平特性,能准确的鉴定每个DNA分子(来源于单个细胞)复制起点是否被使用,也可以
准确计算每个复制起点的使用频率
。通过构建复制起始概率模型
【7】
,利用本工作得到的数据,我们能很好的预测群体水平的复制时序(RT)曲线(与实验获得的时序性曲线相关系数高达0.85,远远高于其它目前测得的复制起点数据)。这强有力的证明了
复制程序的时序调控是基于复制起始位点的使用频率
,也就是说是一个以每个位点复制效率的大小为概率的随机过程。
综上所述,该研究通过交差学科的融合(细胞与分子生物学,生物信息学,数理统计,物理模型等),使用创新的基因组学方法,对人类基因组的复制起始位点在单分子水平的鉴定带来了突破性的进展。
法国居里研究所的
王纬韬
(Weitao Wang)博士生,美国弗罗里达州立大学的
Kyle Klein
博士,加拿大西蒙菲莎大学的
Karel Proesmans
博士,以及美国西北大学的
杨红波
(Hong bo Yang)博士为该文章的共同第一作者,法国居里研究所
陈春龙
(Chunlong Chen)教授,美国麻省医学院
Nick Rhind
教授,弗罗里达州立大学
David M. Gilbert
教授和加拿大西蒙菲莎大学
John Bechhoefer
教授为文章的共同通讯作者。该研究也得到Bionano公司的大力支持。
原文链接:
https://
doi.org/10.1016/j.molce
l.2021.05.024
参考文献
1. Gnan, S., Liu, Y., Spagnuolo, M. & Chen, C.-L. The impact of transcription-mediated replication stress on genome instability and human disease.
Genome Instab. Dis.
1, 207–234 (2020).
2. Ganier, O., Prorok, P., Akerman, I. & Méchali, M. Metazoan DNA replication origins.
Current Opinion in Cell Biology
58, 134–141 (2019).
3. Vouzas, A. E. & Gilbert, D. M. Mammalian DNA Replication Timing.
Cold Spring Harb. Perspect. Biol.
a040162 (2021). doi:10.1101/cshperspect.a040162
4. Long, H. et al. pA.Z facilitates licensing and activation of early replication origins. Nature 577, 576–581 (2020).
5. Petryk, N. et al. Replication landscape of the human genome.
Nat. Commun.
7, 10208 (2016).
6. Promonet, A. et al. Topoisomerase 1 prevents replication stress at R-loop-enriched transcription termination sites.
Nat. Commun.
11, 3940 (2020).
7. Gindin, Y., Valenzuela, M. S., Aladjem, M. I., Meltzer, P. S. & Bilke, S. A chromatin structure-based model accurately predicts DNA replication timing in human cells.
Mol. Syst. Biol.
10, 722 (2014).
转载须知
本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。











