·「大家現在很關註DNA編輯,它的藥效很好,但具有脫靶風險,而且監管要求嚴格。如果RNA編輯能達到和DNA編輯一樣的效果,大家可能就會更傾向於RNA編輯療法的開發。」
當地時間2024年1月29日,美國生物技術公司 Ascidian Therapeutics 宣布旗下在研RNA外顯子編輯療法ACDN-01的研究性新藥(IND)申請獲美國食品藥品監督管理局(FDA)批準,該候選藥物還被授予快速通道資格。
Ascidian新聞稿稱,ACDN-01是第一個獲批進入臨床階段的RNA外顯子編輯療法,並且是首款針對Stargardt病(黃斑萎縮性損害合並視網膜黃色斑點沈著)遺傳原因的臨床階段治療方法。Ascidian預計將於 2024年上半年啟動針對Stargardt病和其他ABCA4相關視網膜病變的1/2期臨床研究的招募工作。
RNA編輯療法是一種基於RNA修飾的新興療法,透過敲除、替換或抑制突變的RNA片段來達到治療遺傳疾病的目的。
近日獲英國、美國等監管機構批準上市的CRISPR/Cas9基因編輯療法Casgevy屬於DNA編輯。相比之下,DNA編輯可一次性、永久性地改變DNA上的基因,RNA編輯不改變基因,而是改變基因的表達。有人將RNA編輯比喻為「糾正檔影印件上的打印錯誤」,而DNA編輯則是「修改原始檔」。
1月30日,中國科學院腦科學與智慧技術卓越創新中心研究員楊輝在接受澎湃科技采訪時表示,RNA編輯和DNA編輯最大的區別是前者不改變DNA序列,因此安全性天然比DNA編輯好一些,不過目前ACDN-01的療效尚待驗證。
「大家現在很關註DNA編輯,它的藥效很好,但具有脫靶風險,而且監管要求嚴格。如果RNA編輯能達到和DNA編輯一樣的效果,大家可能就會更傾向於RNA編輯療法的開發。」楊輝說。
靈感源於海鞘的RNA反式剪接
Ascidian的核心技術是RNA反式剪接(trans-splicing),其靈感來源於低等海洋生物海鞘(ascidian),它是脊椎動物的祖先。海鞘也是Ascidian公司的名稱來源。
為了從幼蟲生長到成蟲,海鞘透過RNA反式剪接和選擇性剪接重新設計它們的轉錄組。受此啟發,Ascidian公司希望透過RNA反式剪接(trans-splicing)編輯和替換人類突變的外顯子,來重寫RNA(RewritingRNA),開發出一種全新的治療方法,從根本上找到解決疾病的方法。
什麽是反式剪接?根據中心法則,DNA轉錄為mRNA,RNA再轉譯為蛋白質,進而執行生命活動。在真核生物中,DNA直接轉錄出來的是前體mRNA(Pre-mRNA),Pre-mRNA要進行剪接,剪除內含子,保留外顯子並拼接,形成成熟mRNA。如果外顯子中出現突變,就可能導致異常蛋白質產生,形成嚴重疾病。
Pre-mRNA的剪接通常是順式剪接(cis-splicing),即在一個Pre-mRNA分子內部發生剪接。反式剪接指兩個不同的Pre-mRNA分子之間發生剪接,形成mRNA雜合體。
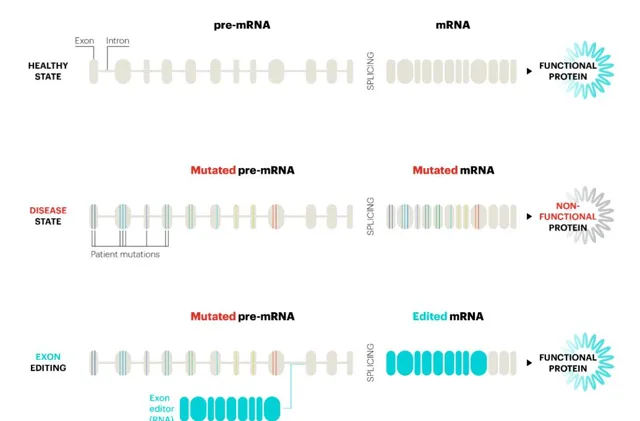
RNA外顯子編輯療法的作用機制。圖片來源:Ascidian官網
Ascidian公司的RNA外顯子編輯平台利用反式剪接,將其與RNA合成技術、深度測序技術,以及經過臨床驗證的遞送技術相結合,將兩個不同的RNA分子精確拼接在一起,形成正確的成熟mRNA,來實作重寫RNA(Rewriting RNA),以恢復正常的蛋白質功能。
與其它只能修改一個RNA堿基的RNA編輯器不同,該技術平台可以替換多個連續的外顯子,從而提供更強大和通用的RNA治療方法。
楊輝向澎湃科技表示,Ascidian公司的RNA編輯技術並非基於CRISPR系統,RNA編輯和DNA編輯最大的區別是前者不改變DNA序列,因此安全性天然比DNA編輯好一些,但有效性可能沒有DNA編輯那麽強。
「DNA的改變是永久性的改變,RNA的改變是可逆的。一個DNA可以轉錄成很多個RNA拷貝,假設有10個RNA拷貝,RNA編輯往往只能糾正3-5個拷貝。但如果糾正1個DNA,這10個RNA拷貝就都糾正了。」他解釋道。
FDA對兩種方法的監管也不同。「FDA一般要求對使用DNA編輯療法的患者至少隨訪15年,而對使用RNA編輯療法的患者的隨訪時長要求是5年。」楊輝說。
有效性待驗證
ACDN-01是一款針對ABCA4基因突變相關視網膜病變的RNA編輯療法。ABCA4基因突變會導致多種遺傳性眼病,包括Stargardt病、視錐視桿細胞營養不良和視網膜色素變性等。
Stargardt病是遺傳性黃斑變性的最常見形式。它是一種原發於視網膜色素上皮層的體染色體隱性遺傳病,ABCA4基因突變是引發Stargardt病的原因之一,該突變導致進行性視網膜變性和視力喪失,通常始於兒童期及青少年時期。
據醫療保健市場研究和商業咨詢公司DelveInsight估計,Stargardt病的患病率為1/10000-1/ 8000,全球約有80萬人受此病影響,美國約有30000多名患者。目前,FDA未批準任何治療Stargardt病的療法上市。
2023年5月9日,Ascidian研究主管Robert Bell博士在2023年美國基因與細胞治療學會年會(ASGCT)上展示了ABCA4計畫的6個月數據,其中包括 ACDN-01 。該數據表明,使用單個AAV遞送的RNA外顯子編輯候選藥物進行一次性治療後,非人靈長類動物視網膜細胞恢復了全長ABCA4蛋白表達。
楊輝認為,ACDN-01可覆蓋的人群數量不少,但療效有待驗證,「Ascidian在去年的ASGCT上披露了體外的數據,但體內的數據還沒有展示。」
Ascidian的RNA編輯療法是否會影響產業?楊輝認為,最終還是要靠人體臨床試驗的數據「說話」,「如果人體臨床試驗的數據好,我覺得會帶動一波相關療法的開發,但如果人體臨床試驗的數據不好,研究人員則要繼續最佳化RNA反式剪接技術。」
盡管ACDN-01尚處早期階段,但已吸引業界關註。「大家現在很關註DNA編輯,它的藥效很好,但具有脫靶風險,而且監管要求嚴格。如果RNA編輯能達到和DNA編輯一樣的效果,大家可能就會更傾向於RNA編輯療法的開發。」楊輝告訴澎湃科技。
公開資訊顯示,總部位於瑞士的羅氏(RHHBY.US)、總部位於美國的禮來(LLY.US)和總部位於英國的葛蘭素史克(GSK.US)等跨國藥企均在RNA編輯領域有所布局。
2023年12月,美國生物技術公司Wave Life Sciences公司宣布其在研RNA編輯療法WVE-006在1期臨床試驗中開始給健康誌願者給藥,WVE-006是一種寡核苷酸療法,旨在治療與α-1抗胰蛋白酶缺乏癥(AATD)相關的肺部或肝臟疾病。葛蘭素史克與Wave達成為期4年的研發合作,Wave可能獲得高達33億美元的款項。
在中國,輝大(上海)生物科技有限公司(以下簡稱「輝大基因」)、博雅輯因(北京)生物科技有限公司(以下簡稱「博雅輯因」)、時夕(廣州)生物科技有限公司和銳正基因(蘇州)有限公司等公司正在開發RNA編輯療法。
2023年9月6日,輝大基因宣布其治療新生血管性年齡相關性黃斑變性的RNA編輯療法HG202在研究者發起的臨床研究(IIT研究)中完成首例患者給藥。2023年10月14日,輝大基因又宣布其RNA編輯療法HG204獲FDA的兒科罕見病資格認定(RPDD),用於治療罕見且致命的兒童神經發育障礙疾病——MECP2重復症候群(MDS)。
2023年5月3日,博雅輯因宣布在第26屆ASGCT年會上,以口頭報告形式釋出其在研體內RNA編輯療法在非人靈長類(NHP)模型(包括疾病模型)中的臨床前概念驗證數據。
(本文來自澎湃新聞,更多原創資訊請下載「澎湃新聞」APP)











