紅肉一般指來自哺乳類動物的肉類,中國的膳食指南稱之為「畜肉」,因為我們日常吃的哺乳類動物就是牛、豬、羊等牲畜,而白肉則泛指其他非哺乳類動物的肉類,包括魚類和禽類等的肉類。
歐美各國的飲食指南都建議減少紅肉的攝入量,中國的膳食指南建議每天食用的禽畜類肉最好在40g-75g之間,沒有明確區分「禽」和「畜」的比例,但有建議優先選擇禽肉和魚肉,但原因主要停留在飽和脂肪在紅肉中較多的原因,也有建議減少煙熏肉類或國外一般稱為加工肉類,因為這些加工過的肉類含有害物質,增加某些腫瘤風險,應該少吃或不吃。[1]
減少紅肉的飲食建議,源於幾十年前對於飽和脂肪的顧慮,Ancel Keys牽頭的7國流行病學研究等把飲食往植物性脂肪引導,盲目崇尚植物脂肪,導致過量的反式脂肪攝入,雖然現在都已經知道反式脂肪雖然是植物脂肪但不利健康,但至今大量增加炎癥的歐米茄6脂肪的煮食油仍然是大眾飲食中的主流,也有越來越多的研究證明脂肪不是罪魁禍首,糖和精制碳水才是。但錯誤的反面不一定就是正確,糖和精制碳水比飽和脂肪造成更大的健康問題,不代表飽和脂肪無罪,飽和脂肪取代精制碳水可以降低血壓和不增加膽固醇[2][3],不代表紅肉不增加炎癥和其他健康問題,盡管瘦的紅肉沒有多少脂肪,但仍存在不少受到詬病的物質,我們在這一篇客觀看一下近年的研究證據。
這一篇不是膳食指南式的文章告訴你少吃或多吃紅肉,而是簡要歸納了近年關於紅肉的流行病學和理論研究,稍微偏理論但不會太深入,旨在說明紅肉不等同飽和脂肪,它的事兒還多著呢。
流行病學研究
我們不能只怪Ancel Keys,幾十年來反對紅肉的其他研究學者都不是吃素的(因為可以吃白肉的,我知道這個梗不太好笑….),多年來實在太多流行病學研究發現紅肉,特別是加工肉類,增加死亡風險,特別是心血管病風險。 單單說飽和脂肪不增加風險是沒有用的,我們吃的是一整塊的紅肉,當中很多物質當年Ancel Keys可能聽都沒用聽過,也有些物質可能現在支持吃紅肉的健康達人也是沒有聽過或不明所以的。這些個別物質留到下兩節,這一節先重溫近年的流行病學研究,因為流行病學研究對於全食物這些多種物質復合物的慢性影響,是有不錯的參考意義的。
1988年的一項長期前瞻性研究跟蹤了2.7萬人群樣本一共20年時間,[4] 發現肉吃多的人全因死亡率,患心血管病和糖尿病的風險增加。這個研究沒有區分紅肉或白肉。
日本發表的5萬多人的前瞻性佇列研究,[5] 則發現適量的紅肉和白肉都跟心血管病死亡率無關。
2003年的前瞻性佇列研究,[6]包括了6個歐美國家的前瞻性研究,發現素食和吃白肉人群的全因死亡率比吃紅肉的較低。2021年義大利發表的一項薈萃分析,[7] 包括了22個前瞻性佇列研究,發現多吃白肉跟全因死亡率有反向關系,輕微降低死亡率風險5%。
2004年一項跟蹤了3.7萬人8.8年時間的前瞻性研究,[8] 調整了各項幹擾因素(體重,卡路裏攝入量,運動,喝酒,抽煙,家庭病史….),仍然發現攝入紅肉較多,增加患上糖尿病風險28%,加工肉類增加風險23%,而一周吃培根香腸這些加工肉類超過4次的,糖尿病風險增加43%。
在2008年世界癌癥研究基金和美國癌癥研究院發表的專家報告,[9] 西方國家發生的癌癥,1/3是跟飲食、營養和運動因素有關的,當中紅肉是10大跟癌癥有關聯性的因素之一。該專家意見是減少紅肉(limit intake of red meat),避開加工肉類(avoid processed meat)以降低癌癥風險。
2009年美國國立癌癥學會發表的研究,[10] 分析了50萬名50-71歲的人群樣本,在10年的跟蹤期間有近4.8萬名男性和2.3萬名女性死亡,分析他們的飲食結構,發現紅肉增加死亡率36%,加工肉類增加死亡率16%。紅肉同時增加癌癥和心血管病死亡風險分別22%和27%,而加工肉類增加癌癥和心血管病死亡風險分別20%和9%。
哈佛大學研究團隊在2012年發表的前瞻性佇列研究,[11] 分析了2個佇列研究的數據,一共12萬人群樣本,這些人在基線都沒有心血管病或癌癥,但在分析期間有5910人死於心血管病,9464人死於癌癥,分析這些人的飲食結構,發現每天每增加一份的加工肉類或紅肉,分別增加死亡率13%和20%。當用其他食物,包括禽類,魚類,堅果,豆類,低脂牛奶和全谷類等,取代紅肉,死亡率降低7%-19%。研究的結論是紅肉增加全因死亡率,心血管病和癌癥的死亡率。
2014年哈佛大學的團隊發表了另一項關於紅肉的橫斷研究,[12] 分析了3690人的血液樣本,發現紅肉的攝入量跟血液中炎癥標誌物CRP和中期血糖標誌物HbA1c有正向關性,多吃紅肉增加炎癥,而禽類,魚類,豆類和堅果等蛋白質來源,則跟較低的炎癥標誌物有關聯性。
但流行病學研究是關聯性研究,[13] 不是所有都發現紅肉增加死亡率,例如瑞士在2013年的研究,樣本人群不算太多但也有1.7萬,在14年間有3683人死亡,其中有1554是死於心血管病,但沒有發現紅肉或白肉的攝入跟全因死亡率或心血管病死亡率有關。
2013歐洲癌癥和營養前瞻性調查(EPIC)研究是一項大型的流行病學研究,[14] 包括了44.8萬人群樣本,在研究期間死亡案例有2.6萬人,發現吃紅肉增加全因死亡率14%,而加工肉類增加死亡風險44%,但吃肉的人一般少吃蔬菜和抽煙,調整了這些幹擾因素後,紅肉並不增加死亡率,只有加工肉類增加風險。該研究還發現不吃紅肉或吃得很少的,死亡率風險比適量吃紅肉的要高。
從多年來流行病學研究的證據,雖然指出紅肉增跟慢性病,心血管病,炎癥和癌癥有相關性,或沒有相關性的證據都有,但正如加州大學聖地亞哥分校的學者指出,[15]對於紅肉跟疾病的關系,流行病學研究的證據是非常一致的(consistent epidemiological associations),當中最差的是加工肉類,但紅肉不能證明是無辜的。
紅肉不利健康的多條路徑
2010年美國國立衛生研究院(NIH)的癌癥分院發表了一項大型前瞻性研究,[16] 跟蹤了30萬人7年時間,當中出現了2719個大腸癌病例。發現紅肉無論是否加工肉類都跟大腸癌的發病風險有正相關性,但白肉則沒有。 分析了樣本人群吃紅肉的種類,例如是否加工肉類,和烹飪的方法和加熱的溫度和時間,總結了紅肉飲食中幾個風險因素。
1) 高溫加熱紅肉會產生致突變劑 (mutagens),包括多環胺類(heterocyclic amines, HCA)以及多環芳烴(polycyclic aromatic hydrocarbons, PAH),增加風險19%;
2) 加工肉類的硝酸鹽和亞硝酸鹽等增加風險16%;
3) 血紅素鐵(heme iron)增加風險13%;
除了上述幾個有關紅肉的風險因素外,紅肉的飽和脂肪過量還是可能增加膽固醇和啟動細胞TLR4訊號,所以也可能導致心血管病風險增加;也有關於TMAO等的研究,我們下面逐一看。
多環胺類 – 有流行病學研究的確發現HCA跟癌癥有關聯性,但也有大型前瞻性研究在本來最直接的大腸癌發病中,沒有找到關聯性,[17] 所以HCA跟癌癥的關聯性證據並不是很一致。 高溫產生的HCA等致癌物不是紅肉的專屬,烤雞烤魚等同樣產生HCA,但白肉跟癌癥和炎癥沒有紅肉一樣的關聯性。[15]
亞硝酸鹽 – 紅肉是可能致癌物,培根香腸等加工肉類才被列為致癌物,因為加工肉類的亞硝酸等化學物會在人體形成亞硝基化合物NOC,而NOC造成DNA損傷,的確致癌和增加身體炎癥。臨床研究也發現不但是加工肉類,吃紅肉也增加NOC。[18] 但流行病學研究沒有發現NOC跟癌癥有很大關系,例如對上海女性人群7萬多人的為期11年前瞻性研究,[19]連最直接的大腸癌都找不到關聯性。胃癌,[20],,膀胱癌[21],食道癌[22]都沒有找到較強的關系。
血紅鐵素 – 紅肉的紅色很大程度來自當中的血紅鐵素(高鐵血色原),過多的鐵造成氧化應激,增加DNA損傷的風險,流行病學研究[23]和動物試驗都支持鐵過量增加大腸癌的風險。 [24] 但膳食來源的血紅鐵素的致癌性應該局限於腸道,因為血液中有血液結合素(hemopexin),對從腸道中進入血液的血紅鐵素有高親和力能快速中和其鐵毒性,而且血鐵紅素跟心血管病沒有明顯關系,當然血鐵紅素影響腸道菌群的平衡,間接導致炎癥的發生,但現今除了大腸癌,可能也包括食道癌之外,沒有發現血紅鐵素跟其他癌癥有很強的關聯性。[15]
飽和脂肪 - 多年來基於心血管病的流行病學研究,目標都釘選在飽和脂肪上,但近年已經證明並不正確,近年的研究已經為飽和脂肪「平反」。 2020年6月,10多家美國和歐洲大學學者聯名發表的一項系統性回顧,[25]研究指出從減少心血管病的角度考慮,減少飽和脂肪並不能降低有關風險,因為碳水化合物會增加血液中內源飽和脂肪的濃度。 2019年的4周短期臨床試驗也發現,吃白肉跟紅肉對血脂指標沒有分別。[26] 而且紅肉的飽和脂肪可能比奶類和椰子油等的飽和脂肪更少,所以純粹說飽和脂肪不能解析紅肉的致炎癥和致癌性。但飽和脂肪的確可以啟動炎癥的細胞訊號(TLR4),過多膳食中的飽和脂肪也會直接(透過胎球蛋白A,FetA)或間接(透過LPS脂多糖)造成身體炎癥。
氧化三甲胺 - 氧化三甲胺(trimethylamine-N-oxide,TMAO)水平升高與心血管病有相關性。紅肉含有較多的左旋肉堿,例如每100g的紅肉含100mg的左旋肉堿,而雞肉和鱈魚只有5mg,腸道菌群會代謝左旋肉堿為中間體TMA,而TMA到達肝臟會轉化為TMAO。[15] TMAO增加血管內壁細胞的炎癥,影響血小板功能增加血栓形成風險,增加動脈粥樣硬化風險。蘇州大學的團隊的一項薈萃分析,[27] 發現TMAO水平高,全因死亡率和心血管病發生率都較高。但TMAO跟心血管病和其他疾病的因果關系並不是很清楚。幹預研究發現補充左旋肉堿,增加腎病透析患者的TMAO同時改善患者的心血管功能。[28]也有幹預研究發現補充左旋肉堿可以降低急性心肌梗塞後的死亡率。[29] 腸道菌群影響對左旋肉堿的代謝,以素食為主的人群,TMAO較少,反映小量紅肉攝入,不會顯著增加TMAO。[30] [31] TMAO對健康的影響不確定,而紅肉也不是唯一增加TMAO的食物,雞蛋和奶類中的膽堿的代謝物也是TMAO,沒有發現雞蛋有紅肉一樣的跟心血管病的強關聯性。
上述都是多年來科學家發現飲食中的紅肉可能導致炎癥,心血管病和癌癥的路徑,但都沒有得到很好的臨床研究證據,很多路徑都不是紅肉專屬,高溫加熱雞肉和魚肉也有HCA,加工肉類的添加劑也不限於紅肉,也有加工的白肉和非肉類,還有這裏沒有提的AGEs致癌物也可以在碳水化合物中存在,所以上述理論雖然都可能是紅肉造成健康影響的路徑,紅肉的確也可能透過多路徑影響我們的健康,但這些理論並不完整。近年科學家們找到一個更能解析紅肉對健康影響的「元兇」 – N-乙酰神經胺酸。
N-羥乙酰神經胺酸
動物包括人類細胞膜上覆蓋有多種稱之為聚糖(glycans)的糖分子,在動物細胞膜上的一種重要N-聚糖分子稱為唾液酸(sialic acid),當中有2個亞型,「N-乙酰神經胺酸」(N-Neu5Ac)和人體不能合成只存在於大部份動物細胞的「N-羥乙酰神經胺酸」(Neu5Gc)。人類在前進演化過程中喪失了轉化Neu5Ac(CMAH酶基因)為Neu5Gc的能力,但科學家卻發現人體細胞中有Neu5Gc,這些聚糖分子在癌癥,炎癥有關疾病發生過程中有關鍵的作用。而人體細胞的表面存在這種人體(包括腸道菌群)不能合成的Neu5Gc,唯一能解析的是這些Neu5Gc是來自我們日常的飲食。[32]

細菌,植物,無脊椎動物,禽類和魚類等白肉都是不能產生Neu5Gc的,[33][34] 但哺乳類動物,包括牛、羊、豬等我們日常的紅肉含有大量的Neu5Gc。動物的前進演化過程中,只有極小部份的動物沒有Neu5Gc,連我們人類近親黑猩猩和大猩猩都有,而在這些小數沒有Neu5Gc生物中,不是吃素的,就是吃魚或吃昆蟲,無脊椎動物的,它們的飲食中不會接收到食物來源的Neu5Gc,所以不會產生抗體。所以除了人類,暫時只找到雪貂和它的近親是既沒有Neu5Gc合成酶基因,又在食物中包含Neu5Gc的。[35]
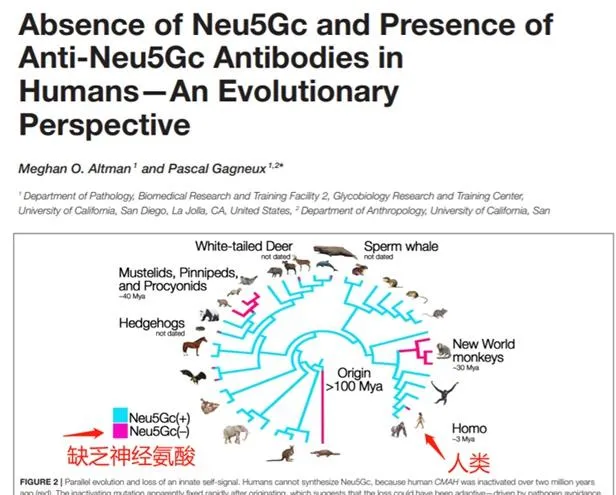
人類沒有的Neu5Gc,成為了人體異種自抗原(xeno-autoantigen),這是一個新詞,從前只有異種抗原(xeno-antigen)指的是來自外物的抗原,而自抗原(autoantigen)指的是來自自身的抗原,一般是自免疫系統疾病患者,例如橋本患者對自身的甲狀腺組織錯誤辨識為抗原,而產生例如TPOAb等自抗體。而「異種自抗原」指的是來自外來的抗原但卻結合到自體細胞內,導致身體的免疫反應對自體細胞產生抗體 – 異種自抗體(xeno-autoantiboties),過多的異種自抗體導致身體慢性炎癥,稱為「Xenosialitis」,好像還沒有譯名,大概可以轉譯為「異種唾液酸炎」。
早在2008年,科學家就開始關註Neu5G在癌癥中的角色。[36]動物實驗發現,當基因改變的小鼠跟人類一樣不能合成Neu5Gc而進食了含Neu5Gc食物後,在這些小鼠註射Neu5Gc抗體,它們出現慢性炎癥,出現腫瘤血管生成(angiogenesis),腫瘤加速生長,把帶有Neu5Gc抗體的小鼠血清移植到其他小鼠,同樣加速這些小鼠的癌細胞生長。但使用壓抑炎癥的藥物後,對Neu5Gc的抗體沒有減少,但抑制了腫瘤血管生成和腫瘤生長,證明對Neu5Gc的自抗體導致慢性炎癥,減少炎癥抑制癌癥發生和癌細胞生長。
2015年的動物實驗,[37] 發現紅肉的N-聚糖分子Neu5Gc可以增加炎癥和致癌。來自加州大學聖地亞哥分校的研究團隊認為,我們膳食中長期有大量的Neu5Gc的話,我們患上癌癥的風險增加5倍,其他跟炎癥有關的疾病包括動脈粥樣硬化,糖尿病等風險同樣增加。紅肉中有大量的Neu5Gc,當不能合成Neu5Gc的小鼠接觸到Neu5Gc,它們的免疫系統判斷這為外來物質,產生對Neu5Gc的抗體,也就是小鼠的慢性炎癥就開始了,研究發現Neu5Gc在小鼠肝臟聚集,小鼠出現肝癌的比例也增加。
2018年加州大學聖地亞哥分校,哈佛大學和劍橋大學的團隊共同發表的一項研究,[38]分析了兩個歐美流行病學研究(Nurse’ Health Professionals, EPIC)的血液樣本,發現血液中對Neu5Gc的抗體總數越多,心血管病風險越大。但雖然對Neu5Gc的抗體是因為紅肉等動物源飲食引起的,吃紅肉的量跟血液中的對Neu5Gc的抗體數量並沒有關聯性。研究人員認為,Neu5Gc的抗體數量跟嬰童時代首次接觸Neu5Gc時有關,也跟一生中累積接觸Neu5Gc的數量有關。我的解讀是,當嬰童時代腸道菌群不理想,對Neu5Gc的抗體就會顯著增加,而年齡越大,累計飲食中的紅肉分量,會增加對Neu5Gc的抗體的數量。但這只是我的個人解讀,需要進一步的前瞻性研究證實。
也的確有研究發現[39],我們腸道中的共生菌可以結合膳食中紅肉來源的Neu5Gc到細菌自己的細胞壁,當我們膳食中含有較多的長鏈脂肪酸時,結合了Neu5Gc的脂多糖LPS就會打包進了乳糜微粒,最終進入人體的血液,刺激免疫系統導致對Neu5Gc的抗體和炎癥產生。那是否膳食中的紅肉和脂肪越多,抗體和炎癥就越嚴重呢?
2020年法國和以色列學者發表的一項研究[40] 分析了19621名人群樣本,發現牛肉的攝入量越多,Neu5Gc也多,而且跟血液中的Neu5Gc抗體(IgG)有正向關系,研究建議對食物中含有的Neu5Gc做標識,可能有助對消費者提出飲食建議以降低癌癥風險。
2021年9月才剛剛發表的一項動物實驗,[41] 在人類基因類似的(不能合成Neu5Gc)的小鼠中加入Neu5Gc,再為小鼠準備美味的高脂食物,小鼠的動脈粥樣硬化數量大幅增加,但從小鼠的飲食中剔除了Neu5Gc,換成Neu5Ac的飲食,盡管繼續高脂肪飲食,小鼠的動脈粥樣硬化大幅減少,研究的結論是Neu5Ac的飲食可以預防小鼠因為紅肉/Neu5Gc導致的動脈粥樣硬化風險,建議類似的幹預研究可以在人類中嘗試。
暫時沒有關於類似上述動物實驗的臨床研究,但2018年的一項對照組臨床試驗,[42] 用大豆取代紅肉,改善了受試者的炎癥指標。75名2型糖尿病患者分3組,紅肉組受試者每周吃2份紅肉,大豆組每周吃3杯分量的大豆,而普通豆類組則每周吃3杯分量的非大豆的豆類。試驗期是8周,之後發現只有大豆組的受試者的炎癥指標有顯著改善,炎癥標準物CRP在大豆組中顯著降低。研究的結論是用大豆置換紅肉可以降低糖尿病患者的氧化應激。
綜合近年Neu5Gc的理論,Neu5Gc是哺乳類動物肌肉細胞的異體抗原,無論是極少飽和脂肪的瘦的紅肉,不高溫加熱不產生有害化學物質的紅肉,還是沒有加工添加劑的新鮮紅肉,都有Neu5Gc,都會刺激免疫系統,過多紅肉無論如何都增加身體炎癥和癌癥風險。
Neu5Gc的和紅肉對健康影響的研究還在進行中,還沒有可以在人類臨床中證明紅肉吃多了,Neu5Gc的抗體就增加,這需要日後進一步的發現,所以如果你覺得一切都需要鐵板釘釘的證據才作出飲食改變的話,看到這裏可以隨意了,但理論可以不完整,我們可能永遠不會弄清楚每一種食物的不同物質對健康的影響,但當流行病學研究都發現較為一致的證據時,盡管不太確定原因,我建議不要跟自己的健康較勁。
應不應該吃紅肉
2007年有平行對照組臨床研究探討過紅肉對身體的影響,[43] 60名健康的受試者,一半的人每天用200g的瘦紅肉取代精制碳水化合物,兩組受試者的卡路裏不變,8周試驗期後發現紅肉取代精制碳水並沒有增加身體炎癥的標誌物。同一個研究團隊也發現,用瘦紅肉取代碳水化合物,8周後可以降低血壓(收縮壓)。[51]
中國的疾控中心在2016年也對紅肉做個流行病學研究,[44] 分析了1991-2015年的中國健康與營養調查的數據,包括了中國15省一共303個城市和鄉鎮,調整了幹擾因素後,發現多吃瘦紅肉的女性,降低高血壓風險32%,而男性則沒有關聯性。
美國國立衛生研究院的癌癥分院在2021年發表了一項紅肉的薈萃分析,[45] 包括了24個臨床幹預研究,發現短期(16周)增加紅肉攝入,不會改變健康但有心血管風險的受試者的血糖和炎癥指標。
但2018年發表的薈萃分析,[46] 包括了66個關於飲食的臨床幹預研究,一共3595名的受試者,比較包括堅果,全谷物,精糧,含糖飲料,紅肉,魚類,蔬果,豆類,雞蛋,奶類等。我們從下表可以看出,紅肉在降低血壓上,的確比精制碳水等更好,但在降低收縮壓不如同樣是蛋白質為主的豆類,在降低CRP炎癥標誌物上,紅肉比精制碳水好,但不如全谷類。這個研究的結果是基於臨床幹預研究的數據,所以參考價值可能比很多流行病學研究更有意義,紅肉在對人體代謝健康上的飲食組合中不是太差,但也不是很好。

肉類含有跟植物源食物中不同比重的微量營養,當中紅肉比白肉在某些地方更勝一籌。紅肉中含有豐富的維生素B,包括B1,B2,B3,B12等,紅肉含的血紅鐵素比植物中的鐵質更容易吸收,素食中的植物化學物例如植酸等都不同程度減少了礦物質的吸收,紅肉中可以有效吸收鋅,硒等。[47]
紅肉的胺基酸種類非常豐富,在中國整體膳食以精制碳水為主,蛋白質普遍不足的情況下,特別對於老人,適量增加蛋白質,包括紅肉,對改善整體健康可能有好處。
2012年的臨床研究發現,[48] 當瘦紅肉增加取代精制碳水,跟專家一致認為健康的DASH飲食比較,同樣可以改善高血脂受試者的各項血脂指標,效果跟DASH飲食相當。
增加膳食中蛋白質的比例,可以增加飽腹感,減少整體卡路裏的攝入,對減少肥胖和肥胖導致的健康問題都有好處。雖然紅肉是主要的蛋白質來源之一,適量增加紅肉作為蛋白質來源對改善整體健康有幫助。[47]
多少紅肉視為適量呢?飲食指南一般建議每天紅肉不要超過0.7份,大概50g左右,但基於幹預研究的薈萃分析,發現可以多於這個劑量,仍然不會增加心血管病風險,就算是每天200g的紅肉,如果取代了精制碳水,對血脂指標沒有壞影響。[49] 但幹預研究都是短期的,而且只是針對單一健康指標,例如膽固醇。 對一些長遠的健康影響,我們也需要參考流行病學研究的數據,2010年哈佛大學發表的薈萃分析,[50] 包括了20個佇列和病例對照組研究,一共121萬人群樣本,當中有2.3萬個心血管病例,1萬個糖尿病病例,發現如果一天100g的紅肉(非加工肉類),並不增加心血管病和糖尿病風險,但每天只需要50g的加工肉類就增加心血管病風險42%。
總結
這篇是關於近年對於紅肉與健康的研究概要:
1 流行病學研究雖然正反兩面的證據都有,但大量的研究證據是證明紅肉不適宜過量,跟心血管病,炎癥,代謝性疾病和癌癥有正相關性;
2 加工肉類或煙熏肉類,比紅肉造成的危害可能更大;
3 紅肉導致健康風險的理論是多路徑的,而近年關於N-羥神經胺酸Neu5Gc刺激我們免疫系統,導致自抗體出現,引致身體慢性炎癥,加速癌細胞生長的理論在動物實驗中已經得到證實;
4 Neu5Gc的理論還沒有可以在人類臨床中證明紅肉吃多了,Neu5Gc的抗體就增加,有待日後進一步的發現;
5 Neu5Gc的重要性:它是哺乳類動物肌肉細胞的異體抗原,無論是瘦的紅肉,不高溫加熱不產生有害物質的紅肉,還是沒有加工添加劑的新鮮紅肉,都有Neu5Gc,都會刺激免疫系統,過多紅肉無論如何都增加身體炎癥和癌癥風險;
6 但紅肉含有豐富蛋白質和微量營養,幹預研究也證明紅肉取代精制碳水化合物,對健康各項指標的改善有幫助,所以適量食用紅肉還是有利健康的,但加工肉類對健康的意義,就沒有適量一說,能不吃就不吃是最有利健康;
7 降低身體炎癥對預防因攝入紅肉導致的慢性炎癥和癌癥風險,有預防作用
免責聲明:
本文內容僅作為科普知識提供,不能代替醫生的治療診斷和建議。文章內容中涉及醫學的部份均來源於參考文獻。
參考
[1] 中國營養學會(2016),中國居民膳食指南(2016版)[M],北京:人民衛生出版社
[2] Maki, K. C., Van Elswyk, M. E., Alexander, D. D., Rains, T. M., Sohn, E. L., & McNeill, S. (2012). A meta-analysis of randomized controlled trials that compare the lipid effects of beef versus poultry and/or fish consumption. Journal of clinical lipidology, 6(4), 352–361. https:// doi.org/10.1016/j.jacl. 2012.01.001
[3] Davidson, M., Hunninghake, D., Maki, K., Kwiterovich, P., & Kafonek, S. (1999). Comparison of the effects of lean red meat vs lean white meat on serum lipid levels among free-living persons with hypercholesterolemia. Archives of Internal Medicine, 155,1331–1338.
[4] Snowdon D. A. (1988). Animal product consumption and mortality because of all causes combined, coronary heart disease, stroke, diabetes, and cancer in Seventh-day Adventists. The American journal of clinical nutrition, 48(3 Suppl), 739–748. https:// doi.org/10.1093/ajcn/48 .3.739
[5] Nagao, M., Iso, H., Yamagishi, K., Date, C., & Tamakoshi, A. (2012). Meat consumption in relation to mortality from cardiovascular disease among Japanese men and women. European journal of clinical nutrition, 66(6), 687–693. https:// doi.org/10.1038/ejcn.20 12.6
[6] Singh, P. N., Sabaté, J., & Fraser, G. E. (2003). Does low meat consumption increase life expectancy in humans?. The American journal of clinical nutrition, 78(3 Suppl), 526S–532S. https:// doi.org/10.1093/ajcn/78 .3.526S
[7] Lupoli, R., Vitale, M., Calabrese, I., Giosuè, A., Riccardi, G., & Vaccaro, O. (2021). White Meat Consumption, All-Cause Mortality, and Cardiovascular Events: A Meta-Analysis of Prospective Cohort Studies. Nutrients, 13(2), 676. https:// doi.org/10.3390/nu13020 676
[8] Song, Y., Manson, J. E., Buring, J. E., & Liu, S. (2004). A prospective study of red meat consumption and type 2 diabetes in middle-aged and elderly women: the women's health study. Diabetes care, 27(9), 2108–2115. https:// doi.org/10.2337/diacare .27.9.2108
[9] Wiseman M. (2008). The second World Cancer Research Fund/American Institute for Cancer Research expert report. Food, nutrition, physical activity, and the prevention of cancer: a global perspective. The Proceedings of the Nutrition Society, 67(3), 253–256. https:// doi.org/10.1017/S002966 510800712X
[10] Sinha, R., Cross, A. J., Graubard, B. I., Leitzmann, M. F., & Schatzkin, A. (2009). Meat intake and mortality: a prospective study of over half a million people. Archives of internal medicine, 169(6), 562–571. https:// doi.org/10.1001/archint ernmed.2009.6
[11] Pan, A., Sun, Q., Bernstein, A. M., Schulze, M. B., Manson, J. E., Stampfer, M. J., Willett, W. C., & Hu, F. B. (2012). Red meat consumption and mortality: results from 2 prospective cohort studies. Archives of internal medicine, 172(7), 555–563. https:// doi.org/10.1001/archint ernmed.2011.2287
[12] Ley, S. H., Sun, Q., Willett, W. C., Eliassen, A. H., Wu, K., Pan, A., Grodstein, F., & Hu, F. B. (2014). Associations between red meat intake and biomarkers of inflammation and glucose metabolism in women. The American journal of clinical nutrition, 99(2), 352–360. https:// doi.org/10.3945/ajcn.11 3.075663
[13] Kappeler, R., Eichholzer, M., & Rohrmann, S. (2013). Meat consumption and diet quality and mortality in NHANES III. European journal of clinical nutrition, 67(6), 598–606. https:// doi.org/10.1038/ejcn.20 13.59
[14] Rohrmann, S., Overvad, K., Bueno-de-Mesquita, H. B., Jakobsen, M. U., Egeberg, R., Tjønneland, A., Nailler, L., Boutron-Ruault, M. C., Clavel-Chapelon, F., Krogh, V., Palli, D., Panico, S., Tumino, R., Ricceri, F., Bergmann, M. M., Boeing, H., Li, K., Kaaks, R., Khaw, K. T., Wareham, N. J., … Linseisen, J. (2013). Meat consumption and mortality--results from the European Prospective Investigation into Cancer and Nutrition. BMC medicine, 11, 63. https:// doi.org/10.1186/1741-70 15-11-63
[15] Alisson-Silva, F., Kawanishi, K., & Varki, A. (2016). Human risk of diseases associated with red meat intake: Analysis of current theories and proposed role for metabolic incorporation of a non-human sialic acid. Molecular aspects of medicine, 51, 16–30. https:// doi.org/10.1016/j.mam.2 016.07.002
[16] Cross, A. J., Ferrucci, L. M., Risch, A., Graubard, B. I., Ward, M. H., Park, Y., Hollenbeck, A. R., Schatzkin, A., & Sinha, R. (2010). A large prospective study of meat consumption and colorectal cancer risk: an investigation of potential mechanisms underlying this association. Cancer research, 70(6), 2406–2414. https:// doi.org/10.1158/0008-54 72.CAN-09-3929
[17] Le, N. T., Michels, F. A., Song, M., Zhang, X., Bernstein, A. M., Giovannucci, E. L., Fuchs, C. S., Ogino, S., Chan, A. T., Sinha, R., Willett, W. C., & Wu, K. (2016). A Prospective Analysis of Meat Mutagens and Colorectal Cancer in the Nurses' Health Study and Health Professionals Follow-up Study. Environmental health perspectives, 124(10), 1529–1536. https:// doi.org/10.1289/EHP238
[18] Hughes, R., Cross, A. J., Pollock, J. R., & Bingham, S. (2001). Dose-dependent effect of dietary meat on endogenous colonic N-nitrosation. Carcinogenesis, 22(1), 199–202. https:// doi.org/10.1093/carcin/ 22.1.199
[19] Dellavalle, C. T., Xiao, Q., Yang, G., Shu, X. O., Aschebrook-Kilfoy, B., Zheng, W., Lan Li, H., Ji, B. T., Rothman, N., Chow, W. H., Gao, Y. T., & Ward, M. H. (2014). Dietary nitrate and nitrite intake and risk of colorectal cancer in the Shanghai Women's Health Study. International journal of cancer, 134(12), 2917–2926. https:// doi.org/10.1002/ijc.286 12
[20] Song, P., Wu, L., & Guan, W. (2015). Dietary Nitrates, Nitrites, and Nitrosamines Intake and the Risk of Gastric Cancer: A Meta-Analysis. Nutrients, 7(12), 9872–9895. https:// doi.org/10.3390/nu71255 05
[21] Ferrucci, L. M., Sinha, R., Ward, M. H., Graubard, B. I., Hollenbeck, A. R., Kilfoy, B. A., Schatzkin, A., Michaud, D. S., & Cross, A. J. (2010). Meat and components of meat and the risk of bladder cancer in the NIH-AARP Diet and Health Study. Cancer, 116(18), 4345–4353. https:// doi.org/10.1002/cncr.25 463
[22] Keszei, A. P., Goldbohm, R. A., Schouten, L. J., Jakszyn, P., & van den Brandt, P. A. (2013). Dietary N-nitroso compounds, endogenous nitrosation, and the risk of esophageal and gastric cancer subtypes in the Netherlands Cohort Study. The American journal of clinical nutrition, 97(1), 135–146. https:// doi.org/10.3945/ajcn.11 2.043885
[23] Bastide, N. M., Pierre, F. H., & Corpet, D. E. (2011). Heme iron from meat and risk of colorectal cancer: a meta-analysis and a review of the mechanisms involved. Cancer prevention research (Philadelphia, Pa.), 4(2), 177–184. https:// doi.org/10.1158/1940-62 07.CAPR-10-0113
[24] IJssennagger, N., Rijnierse, A., de Wit, N., Jonker-Termont, D., Dekker, J., Müller, M., & van der Meer, R. (2012). Dietary haem stimulates epithelial cell turnover by downregulating feedback inhibitors of proliferation in murine colon. Gut, 61(7), 1041–1049. https:// doi.org/10.1136/gutjnl- 2011-300239
[25] Astrup, A., Magkos, F., Bier, D. M., Brenna, J. T., de Oliveira Otto, M. C., Hill, J. O., King, J. C., Mente, A., Ordovas, J. M., Volek, J. S., Yusuf, S., & Krauss, R. M. (2020). Saturated Fats and Health: A Reassessment and Proposal for Food-based Recommendations: JACC State-of -the-Art Review. Journal of the American College of Cardiology, S0735-1097(20)35687-4. Advance online publication. https:// doi.org/10.1016/j.jacc .
[26] Bergeron, N., Chiu, S., Williams, P. T., M King, S., & Krauss, R. M. (2019). Effects of red meat, white meat, and nonmeat protein sources on atherogenic lipoprotein measures in the context of low compared with high saturated fat intake: a randomized controlled trial. The American journal of clinical nutrition, 110(1), 24–33. https:// doi.org/10.1093/ajcn/nq z035
[27] Qi, J., You, T., Li, J., Pan, T., Xiang, L., Han, Y., & Zhu, L. (2018). Circulating trimethylamine N-oxide and the risk of cardiovascular diseases: a systematic review and meta-analysis of 11 prospective cohort studies. Journal of cellular and molecular medicine, 22(1), 185–194. https:// doi.org/10.1111/jcmm.13 307
[28] Fukami, K., Yamagishi, S., Sakai, K., Kaida, Y., Yokoro, M., Ueda, S., Wada, Y., Takeuchi, M., Shimizu, M., Yamazaki, H., & Okuda, S. (2015). Oral L-carnitine supplementation increases trimethylamine-N-oxide but reduces markers of vascular injury in hemodialysis patients. Journal of cardiovascular pharmacology, 65(3), 289–295. https:// doi.org/10.1097/FJC.000 0000000000197
[29] Tarantini, G., Scrutinio, D., Bruzzi, P., Boni, L., Rizzon, P., & Iliceto, S. (2006). Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology, 106(4), 215–223. https:// doi.org/10.1159/0000931 31
[30] Koeth, R. A., Wang, Z., Levison, B. S., Buffa, J. A., Org, E., Sheehy, B. T., Britt, E. B., Fu, X., Wu, Y., Li, L., Smith, J. D., DiDonato, J. A., Chen, J., Li, H., Wu, G. D., Lewis, J. D., Warrier, M., Brown, J. M., Krauss, R. M., Tang, W. H., … Hazen, S. L. (2013). Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nature medicine, 19(5), 576–585. https:// doi.org/10.1038/nm.3145
[31] Wu, W. K., Panyod, S., Liu, P. Y., Chen, C. C., Kao, H. L., Chuang, H. L., Chen, Y. H., Zou, H. B., Kuo, H. C., Kuo, C. H., Liao, B. Y., Chiu, T., Chung, C. H., Lin, A. Y., Lee, Y. C., Tang, S. L., Wang, J. T., Wu, Y. W., Hsu, C. C., Sheen, L. Y., … Wu, M. S. (2020). Characterization of TMAO productivity from carnitine challenge facilitates personalized nutrition and microbiome signatures discovery. Microbiome, 8(1), 162. https:// doi.org/10.1186/s40168- 020-00912-y
[32] Dhar, C., Sasmal, A., & Varki, A. (2019). From "Serum Sickness" to "Xenosialitis": Past, Present, and Future Significance of the Non-human Sialic Acid Neu5Gc. Frontiers in immunology, 10, 807. https:// doi.org/10.3389/fimmu.2 019.00807
[33] Jahan, M., Francis, N., Wynn, P., & Wang, B. (2021). The Potential for Sialic Acid and Sialylated Glycoconjugates as Feed Additives to Enhance Pig Health and Production. Animals : an open access journal from MDPI, 11(8), 2318. https:// doi.org/10.3390/ani1108 2318
[34] Maru, I., Ohnishi, J., Ohta, Y., & Tsukada, Y. (2002). Why is sialic acid attracting interest now? Complete enzymatic synthesis of sialic acid with N-acylglucosamine 2-epimerase. Journal of bioscience and bioengineering, 93(3), 258–265. https:// doi.org/10.1263/jbb.93. 258
[35] Altman, M. O., & Gagneux, P. (2019). Absence of Neu5Gc and Presence of Anti-Neu5Gc Antibodies in Humans-An Evolutionary Perspective. Frontiers in immunology, 10, 789. https:// doi.org/10.3389/fimmu.2 019.00789
[36] Hedlund, M., Padler-Karavani, V., Varki, N. M., & Varki, A. (2008). Evidence for a human-specific mechanism for diet and antibody-mediated inflammation in carcinoma progression. Proceedings of the National Academy of Sciences of the United States of America, 105(48), 18936–18941. https:// doi.org/10.1073/pnas.08 03943105
[37] Samraj, A. N., Pearce, O. M., Läubli, H., Crittenden, A. N., Bergfeld, A. K., Banda, K., Gregg, C. J., Bingman, A. E., Secrest, P., Diaz, S. L., Varki, N. M., & Varki, A. (2015). A red meat-derived glycan promotes inflammation and cancer progression. Proceedings of the National Academy of Sciences of the United States of America, 112(2), 542–547. https:// doi.org/10.1073/pnas.14 17508112
[38] Samraj, A. N., Bertrand, K. A., Luben, R., Khedri, Z., Yu, H., Nguyen, D., Gregg, C. J., Diaz, S. L., Sawyer, S., Chen, X., Eliassen, H., Padler-Karavani, V., Wu, K., Khaw, K. T., Willett, W., & Varki, A. (2018). Polyclonal human antibodies against glycans bearing red meat-derived non-human sialic acid N-glycolylneuraminic acid are stable, reproducible, complex and vary between individuals: Total antibody levels are associated with colorectal cancer risk. PloS one, 13(6), e0197464. https:// doi.org/10.1371/journal .pone.0197464
[39] Samraj, A. N., Läubli, H., Varki, N., & Varki, A. (2014). Involvement of a non-human sialic Acid in human cancer. Frontiers in oncology, 4, 33. https:// doi.org/10.3389/fonc.20 14.00033
[40] Bashir, S., Fezeu, L. K., Leviatan Ben-Arye, S., Yehuda, S., Reuven, E. M., Szabo de Edelenyi, F., Fellah-Hebia, I., Le Tourneau, T., Imbert-Marcille, B. M., Drouet, E. B., Touvier, M., Roussel, J. C., Yu, H., Chen, X., Hercberg, S., Cozzi, E., Soulillou, J. P., Galan, P., & Padler-Karavani, V. (2020). Association between Neu5Gc carbohydrate and serum antibodies against it provides the molecular link to cancer: French NutriNet-Santé study. BMC medicine, 18(1), 262. https:// doi.org/10.1186/s12916- 020-01721-8
[41] Kawanishi, Kunio & Coker, Joanna & Grunddal, Kaare & Dhar, Chirag & Hsiao, Jason & Zengler, Karsten & Varki, Nissi & Varki, Ajit & Gordts, Philip. (2021). Dietary Neu5Ac Intervention Protects Against Atherosclerosis Associated With Human-Like Neu5Gc Loss. Arteriosclerosis, Thrombosis, and Vascular Biology. 10.1161/ATVBAHA.120.315280.
[42] Hematdar, Z., Ghasemifard, N., Phishdad, G., & Faghih, S. (2018). Substitution of red meat with soybean but not non- soy legumes improves inflammation in patients with type 2 diabetes; a randomized clinical trial. Journal of diabetes and metabolic disorders, 17(2), 111–116. https:// doi.org/10.1007/s40200- 018-0346-6
[43] Hodgson, J. M., Ward, N. C., Burke, V., Beilin, L. J., & Puddey, I. B. (2007). Increased lean red meat intake does not elevate markers of oxidative stress and inflammation in humans. The Journal of nutrition, 137(2), 363–367. https:// doi.org/10.1093/jn/137. 2.363
[44] Wang, Z., Huang, Q., Wang, L., Jiang, H., Wang, Y., Wang, H., Zhang, J., Zhai, F., & Zhang, B. (2020). Moderate Intake of Lean Red Meat was Associated with Lower Risk of Elevated Blood Pressure in Chinese Women: Results from the China Health and Nutrition Survey, 1991-2015. Nutrients, 12(5), 1369. https:// doi.org/10.3390/nu12051 369
[45] O'Connor, L. E., Kim, J. E., Clark, C. M., Zhu, W., & Campbell, W. W. (2021). Effects of Total Red Meat Intake on Glycemic Control and Inflammatory Biomarkers: A Meta-Analysis of Randomized Controlled Trials. Advances in nutrition (Bethesda, Md.), 12(1), 115–127. https:// doi.org/10.1093/advance s/nmaa096
[46] Schwingshackl, L., Hoffmann, G., Iqbal, K., Schwedhelm, C., & Boeing, H. (2018). Food groups and intermediate disease markers: a systematic review and network meta-analysis of randomized trials. The American journal of clinical nutrition, 108(3), 576–586. https:// doi.org/10.1093/ajcn/nq y151
[47] Binnie, M. A., Barlow, K., Johnson, V., & Harrison, C. (2014). Red meats: time for a paradigm shift in dietary advice. Meat science, 98(3), 445–451. https:// doi.org/10.1016/j.meats ci.2014.06.024
[48] Roussell, M. A., Hill, A. M., Gaugler, T. L., West, S. G., Heuvel, J. P., Alaupovic, P., Gillies, P. J., & Kris-Etherton, P. M. (2012). Beef in an Optimal Lean Diet study: effects on lipids, lipoproteins, and apolipoproteins. The American journal of clinical nutrition, 95(1), 9–16. https:// doi.org/10.3945/ajcn.11 1.016261
[49] O'Connor, L. E., Kim, J. E., & Campbell, W. W. (2017). Total red meat intake of ≥0.5 servings/d does not negatively influence cardiovascular disease risk factors: a systemically searched meta-analysis of randomized controlled trials. The American journal of clinical nutrition, 105(1), 57–69. https:// doi.org/10.3945/ajcn.11 6.142521
[50] Micha, R., Wallace, S. K., & Mozaffarian, D. (2010). Red and processed meat consumption and risk of incident coronary heart disease, stroke, and diabetes mellitus: a systematic review and meta-analysis. Circulation, 121(21), 2271–2283. https:// doi.org/10.1161/CIRCULA TIONAHA.109.924977
[51] Hodgson, J. M., Burke, V., Beilin, L. J., & Puddey, I. B. (2006). Partial substitution of carbohydrate intake with protein intake from lean red meat lowers blood pressure in hypertensive persons. The American journal of clinical nutrition, 83(4), 780–787. https:// doi.org/10.1093/ajcn/83 .4.780











